β折叠
外观
(重定向自Β-摺疊)
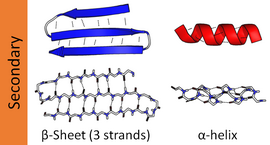


β折叠(β-sheet),又称β片层结构(β-pleated sheet),是蛋白质的一种二级结构。
在β折叠中,两条以上氨基酸链(肽链),或同一条肽链之间的不同部分形成平行或反平行排列,成为“股”。肽平面之间呈手风琴状折叠,股与股之间会通过氢键固定,但氢键主要在股间而不是股内。氨基酸残基的R侧链分布在片层的上下。
β折叠层并不是平的,因为侧链的存在使得它看上去像手风琴一样波纹起伏。(英语pleated)这样每一股会更紧密排列,氢键更容易建立。氢键的距离为7埃。在蛋白质结构中β折叠通常会用箭头表示。肽链的氮端在同侧为顺式,两残基间距为0.65nm;不在同侧为反式,两残基间距为0.70nm。反式较顺式平行折叠更加稳定。
能形成β折叠的氨基酸残基一般不大,而且不带同种电荷,这样有利于多肽链的伸展,如甘氨酸、丙氨酸在β折叠中出现的几率最高。免疫球蛋白有大量的β折叠层。
另一种常见的蛋白质模序是α螺旋和三种不同的β转角。不属于一个模序的蛋白质一级结构部分被称之为不规则螺旋。这些部分对蛋白质的空间构象非常重要。
延伸閲讀
[编辑]- Cooper J. Super Secondary Structure - Part II. Principles of Protein Structure Using the Internet. 31 May 1996 [25 May 2007]. (原始内容存档于2016-12-28).
- Open-sided Beta-meander. Structural Classification of Proteins (SCOP). 20 October 2006 [31 May 2007]. (原始内容存档于2012-02-04).
參見
[编辑]外部链接
[编辑]- (英文)Anatomy & Taxonomy of Protein Structures -survey (页面存档备份,存于互联网档案馆)
- (英文)NetSurfP - Secondary Structure and Surface Accessibility predictor (页面存档备份,存于互联网档案馆)
- (英文)Interactive model of an anti-parallel β sheet (plug-in required)
- (英文)Interactive model of a parallel β sheet (plug-in required)
- (英文)Animated details of β-pleated sheet[永久失效連結]
- (英文)Monooxygenase (页面存档备份,存于互联网档案馆)
- 精美的蛋白质二级结构图示
