化學元素豐度
此條目翻譯品質不佳。 |
化學元素豐度(英語:Chemical element abundance)是指在給定環境中某化學元素相對於其他所有元素含量多寡的比值。豐度可以是質量的比值或是莫爾數(氣體的原子數量比值或是分子數量比值),或是容積比值。在混合氣體中測量氣體容積比值是表示豐度的常用方法,對混合的理想氣體(相對於是低密度和低壓的氣體)這與莫耳數相當一致。
例如,氧元素在水中的質量比是89%,意思是水的質量和氧元素的質量的比值,但氧在水中的莫爾比值只有33%,因為在水的莫爾數中只有三分之一是氧原子。在整個宇宙中,比如像木星這樣的巨大的氣體行星中,氫和氦的質量豐度比值分別是74%和23~25%,但是摩爾(原子)比值卻高達92%和8%。但是,因為氫是雙原子分子,而氦在木星外層的大氣環境下只是單原子分子,以分子的摩爾數來比較,在木星大氣層中氫的豐度是86%,而氦的豐度是13%。
本文提到的豐度多數都是質量百分比。
宇宙中的元素豐度
[编辑]| 同位素 | 核 百萬分比 |
|---|---|
| 氫-1 | 705,700 |
| 氦-4 | 275,200 |
| 氧-16 | 5,920 |
| 碳-12 | 3,032 |
| 氖-20 | 1,548 |
| 鐵-56 | 1,169 |
| 氮-14 | 1,105 |
| 矽-28 | 653 |
| 鎂-24 | 513 |
| 硫-32 | 396 |
| 氖-22 | 208 |
| 鎂-26 | 79 |
| 氬-36 | 77 |
| 鐵-54 | 72 |
| 鎂-25 | 69 |
| 鈣-40 | 60 |
| 鋁-27 | 58 |
| 鎳-58 | 49 |
| 碳-13 | 37 |
| 氦-3 | 35 |
| 矽-29 | 34 |
| 鈉-23 | 33 |
| 鐵-57 | 28 |
| 氘-2 | 23 |
| 矽-30 | 23 |
元素,通常指由質子、中子和電子組成的物質(重子),在宇宙中的質量僅佔極小的部份。觀測宇宙學指出宇宙成分有73%是暗能量,23%是暗物質,只有4%是看得見的重子物質,包括恆星、行星和生物。在質點物理中尚未發現暗物質,而暗能量的本質尚未清楚。
許多標準的重子物質被以原子或電漿的形式被發現,但仍然還有許多種平常不易見到的物質。重子物質的其他型態還包括白矮星、中子星和黑洞,標準的物質也以光子的型態存在(許多都是宇宙微波背景輻射和微中子)。
氫是宇宙中已知豐度最高的元素,氦是第二。然而,在這之後,豐度的數值順序就不再依據原子序來排列。氧的豐度佔第三位,但它的原子序是8,其他的各種元素豐度就更沒有規律可循了。[2]
輕元素的豐度可以依循標準宇宙模型來預測,因為都是在大霹靂之後很短的時間(在幾百秒鐘)內,經由現在所認知的太初核合成的程序產生的;重元素則是在之後很久才在恆星內部產生的。
氦3在地球很罕見,並且僅出現在核融合的研究中,但認為氦-3的豐度在月球上會較高。額外的氦來自於恆星內部的氫融合成氦的質子-質子鏈反應和碳氮氧循環。
估計氫和氦在重子的宇宙的豐度分別是74%和24%,宇宙中剩餘很小的豐度是重元素,但剩餘的重元素對天文現象有很大的影響,銀河系的盤面中只有2%的質量是由重元素組成。
其他的元素來自恆星內部的程序[3][4][5]。天文學將比氫和氦重的元素稱為「金屬」,這是因為只有氫和氦(包含可偵測到的微量鋰元素)是自然界無須經由恆星內部核融合活動產生的元素。因此,星系的金屬量或其他的特徵足以顯示恆星過去的活動。
| 元素 | 百萬分比 |
|---|---|
| 氫 | 750,000 |
| 氦 | 230,000 |
| 氧 | 10,000 |
| 碳 | 5,000 |
| 氖 | 1,300 |
| 鐵 | 1,100 |
| 氮 | 1000 |
| 矽 | 700 |
| 鎂 | 600 |
| 硫 | 500 |
地球上元素的豐度
[编辑]地球與太陽都在同一片星雲中形成,但是在太陽系的形成和演化的過程中行星得到不同成分。地球的歷史導致這顆行星的部份元素有不同的集中程度。
地球的地殼元素豐度
[编辑]這張圖表顯示地球的上層大陸地殼中元素的相對豐度。
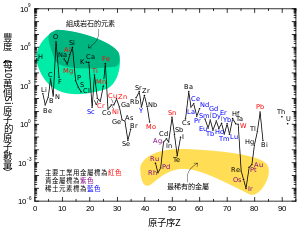
許多顯示在圖表中的元素都被分類在目錄當中(有部分重疊):
- 形成岩石的元素(主要元素在綠色的區域少數的元素在淡綠色的區域);
- 稀土元素(鑭族元素,鑭-鑥和釔,標示藍色的區域);
- 主要的工業元素(全球年產值>~3×107公斤;標示為粗黑字體);
- 貴金屬(斜體字);
- 九種"贵稀金屬"—六種鉑族元素加上金、錸和碲(類金屬)
注意有兩個不穩定元素鎝(原子序43)和鉕(原子序61)的斷裂存在。它們在地球上非常罕見,只能經由重元素,例如鈾或釷的分裂產生。這兩種元素在恆星大氣的分光中被確認,它們是在持續的核綜合過程中產生的。在六種惰性氣體處也有斷裂,它們是因為放射性元素的放射性衰變鏈才在地殼中被發現,原本並不存在於地殼中。這六種元素非常稀有,高放射性的元素(釙、砈、鈁、鐳、錒和鏷)因為它們在自然界的豐度太低,以致於不能準確的測量,因此不包括在其中。
「稀土」元素的豐度
[编辑]「稀土」元素是歷史上的一個錯誤名詞,堅持使用這個名詞只是反映出對它們的不熟悉而不是真的很稀少。比較豐富的稀土元素在地殼中會與相似的工業金屬混合在一起,這些金屬包括鉻、鎳、銅、鋅、鉬、錫、鎢或鉛,但即使是豐度最低的兩種稀土元素(銩和镏)也仍比普通的金高出200倍。然而,相較於普通的基礎元素和貴金屬,稀土元素沒有傾向集中的沉積礦而只有少數可開採的氧化物礦床,因此大多數的稀土元素在世界上的供應來源都是屈指可數的。
稀土元素在地球的大陸地殼上層個別的豐度表現出兩種性質並且有所重疊,一種是原子核的,另一種是地質上的。首先,原子序是偶數的稀土元素(58Ce, 60Nd, ...)在宇宙中的豐度較相鄰原子序為奇數的稀土元素(57La,59Pr,…)為高。其次,越輕的稀土元素越不相容(因為它們的電離半徑越大),因此它們在大陸地殼中比重的稀土元素更為集中。大多數的稀土元素都聚在一起,最前面的四種稀土元素鑭、鈰、鐠和釹就佔稀土總數的80%至99%。
海洋
[编辑]| 元素 | 百分比 | 元素 | 百分比 |
|---|---|---|---|
| 氧 | 85.84 | 硫 | 0.091 |
| 氫 | 10.82 | 鈣 | 0.04 |
| 氯 | 1.94 | 鉀 | 0.04 |
| 鈉 | 1.08 | 溴 | 0.0067 |
| 鎂 | 0.1292 | 碳 | 0.0028 |
參見海洋中海水中元素的豐度,但是注意是以質量來排序的,若以容積(摩爾數)來排序,前面四種元素會非常的不一樣;特別是氫幾乎佔到所有原子數量的三分之二,因為構成水分子的三個原子中就有兩個是氫原子。
大氣層
[编辑]地球大氣層的元素容積比率依照順序是氮(78.1%)、氧(20.9%)、氬(0.96%);水蒸氣和二氧化碳會由各種途徑進入大氣層,並影响到容積率,接下來是順序不確定的碳和氫。硫、磷和其他元素在大氣中的比率更低。
由上面的圖,氬在大氣中雖顯著但並不是主要的,但在地殼中幾乎完全不存在。這是因為大氣的質量遠小於地殼,使得留在地殼中為數不多的氬在比例上完全顯現不出來,而氬在大氣中由于密度接近空气,可以累積的量多到足以顯示其重要性。由於氬是惰性氣體,因此難以留在地殼中。同为惰性气体(稀有气体)的氦却在地壳中有较大含量,那是因为它们多产生于重元素的α衰变,并且被岩石等阻挡不易逃逸。
人體
[编辑]依據質量,人體的細胞包含65%至90%水(H2O),另一個重要的部份是由包含碳的有機分子組成,因此氧在人體中的貢獻接續碳之後比例也有很大的。人體質量的99%是由下列六種元素構成的:氧、碳、氫、氮、鈣和磷。
| 元素 | 質量百分比 |
|---|---|
| 氧 | 65 |
| 碳 | 18 |
| 氫 | 10 |
| 氮 | 3 |
| 鈣 | 1.5 |
| 磷 | 1.2 |
| 鉀 | 0.2 |
| 硫 | 0.2 |
| 氯 | 0.2 |
| 鈉 | 0.1 |
| 鎂 | 0.05 |
| 鐵、鈷、銅、鋅、碘 | <0.05 個別 |
| 硒、氟 | <0.01 個別 |
相關條目
[编辑]- 自然豐度(同位素豐度)
註解和參考資料
[编辑]- ^ Arnett, David. Supernovae and Nucleosynthesis First edition. Princeton, New Jersey: Princeton University Press. 1996. ISBN 0-691-01147-8. OCLC 33162440.
- ^ 存档副本. [2019-12-30]. (原始内容存档于2012-08-25).
- ^ H. E. Suess and H. C. Urey (1956) Abundances of the elements, Rev Mod Phys 28:53-74.
- ^ A. G. W. Cameron (1973) Abundances of the elements in the solar system, Space Sci Rev 15:121-146.
- ^ E. Anders and M. Ebihara (1982) Solar-system abundances of the elements, Geochim. Cosmochim. Acta 46:2363-2380.
- ^ Ash, Russell, The Top 10 of Everything 2006: The Ultimate Book of Lists, Dk Pub, 2005 [2008-11-26], ISBN 0756613213, (原始内容存档于2010-02-10).
外部連結
[编辑]- List of elements in order of abundance in the Earth's crust (页面存档备份,存于互联网档案馆) (only correct for the twenty most common elements)
- Cosmic abundance of the elements and nucleosynthesis
- 這篇文章的部分資料取材自公共領域的資源,來源是: http://geopubs.wr.usgs.gov/fact-sheet/fs087-02/ (页面存档备份,存于互联网档案馆) and https://web.archive.org/web/20031203202925/http://imagine.gsfc.nasa.gov/docs/dict_ei.html 請視需要更新。
參考文獻
[编辑]Chang, Raymond. Chemistry, Ninth Edition. McGraw-Hill. 2007: p. 52. ISBN 0-07-110595-6.
