坏死
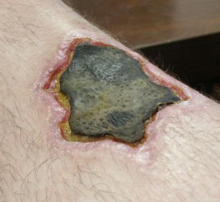
坏死(英语:Necrosis),又称细胞坏死,被认为是一种由外部或内部物理性因素(例如热力、应力和辐射等)、强碱、强酸及毒物等化学性因素,以及内毒素和病原体等生物性因素诱发的永久性细胞或活体组织死亡,并且具有是混乱无序且基本上不可控(部分类型的坏死是可以被信号传导通路所控制,例如死亡域受体和类铎受体)的特征,一旦发生则难以逆转。它跟细胞凋亡不同,细胞凋亡是细胞正常性的死亡,通常对生物的身体及成长是有益的,而坏死通常是指因外在因素造成病理性或非正常的细胞死亡。
坏死并不是在2005年首次报道的“程序性坏死”(Necroptosis),两者不能混作一说。程序性坏死是一种程序性细胞死亡,并且与细胞凋亡的病理学特征截然不同,它的发生不由胱天蛋白酶主控,而且没有线粒体细胞色素c的释放[1]。
形态学模式
[编辑]细胞坏死有六种常见且独特的形态学模式[2]:
- 凝固性坏死的特征是在死亡组织中形成凝胶状物质,令组织的结构得以维持[2] ,并且可以透过光学显微镜进行观察。凝固作用是蛋白质变性的结果,导致白蛋白转变为牢固和不透明的状态[3]。这种坏死模式通常出现在梗塞等缺氧或低氧环境中。凝固性坏死主要发生在肾脏、心脏和肾上腺等组织中[3],而严重的缺血也经常会导致凝固性坏死[4]。
- 液化性坏死的特征是已消化的坏死组织因酶性分解而发生溶解液化,并且形成粘性液体[2]。这是细菌感染或真菌感染的典型特征,因为它们具有刺激炎症反应的能力。由于存在死亡的白细胞,脓液通常呈乳黄色[2]。脑缺氧性梗死的表现为液化性坏死,因为脑中的结缔组织很少,但是消化酶和脂质的含量很高,因此细胞可以很容易地被自身的酶所消化[3]。
- 干酪样坏死可以被认为是凝固性坏性和液化性坏死的结合[3],通常由结核杆菌、真菌和某些外来物质引起。干酪性坏死的组织看起来像块状的白色奶酪,并且易碎。干酪性坏死的细胞被分解,但是未被完全消化,并且留下颗粒状颗粒[3]。显微镜检查显示无定形颗粒状碎片包裹在明显的炎症边界内[2] ,而肉芽肿同样具有这种特征[6] 。
- 脂肪性坏死是脂肪组织的特异性坏死[6],并且是由于已活化的脂酶对脂肪组织的作用所致。它会在胰脏中导致急性胰腺炎,胰酶会渗入腹膜腔,并且通过脂肪皂化反应将甘油三酯分解为脂肪酸,从而把膜液化[2]。钙、镁或钠可能与这些病灶结合,产生一些白色物质,而钙沉积物在显微镜下是独特的,并且可能在射线照相检查中可被看见。钙沉积物在肉眼观察时为坚硬的白色斑点[4]。
其他形态学模式
[编辑]- 坏死也有其他非常特殊的形态学模式,例如坏疽(严重缺氧的肢体在临床实践中使用的术语)、由于螺旋体感染而引发的梅毒肿性坏死(gummatous necrosis)和由于器官或组织的静脉引流受阻而引发的出血性坏死(hemorrhagic necrosis)。
- 被某些蜘蛛咬伤可能导致细胞坏死。在美国,只有棕色遁蛛造成的咬伤能发展为坏死。已知在其他国家也具有相同属的蜘蛛,例如南美的智利遁蛛也会引起坏死。关于红螯蛛属和Hobo spider具有导致坏死毒液的说法尚未得到证实。
- 在鼹形鼠亚科中,坏死过程取代了在许多生物中使用的系统性细胞凋亡的作用。低氧条件,例如鼹形鼠亚科洞穴中常见的条件,通常会导致细胞凋亡。为了适应更高的细胞死亡趋势,鼹形鼠亚科在肿瘤抑制蛋白p53中进化出一种突变,以阻止细胞凋亡。人类癌症患者俱有类似的突变,并且认为鼹形鼠亚科更易患癌症,因为它们的细胞无法凋亡。根据罗彻斯特大学进行的一项研究,鼹形鼠亚科的细胞在三天之内,就会因过度刺激而释放β型干扰素。细胞增殖受到细胞凋亡的抑制。在这种情况下,β型干扰素会触发细胞坏死,而这种机制还杀死了鼹形鼠亚科的癌细胞。 由于这种肿瘤抑制机制,鼹形鼠亚科和其他鼹形鼠科对癌症具有抵抗力[7][8] 。
鉴别
[编辑]确定是否为坏死需要具有以下的条件:
首先,必须要在显微镜的观察下呈坏死样细胞的典型形态学特征是必备条件。第二,要坏死细胞中的细胞膜完整性是否受到破坏。第三,坏死周围组织的炎性反应是与细胞凋亡的重要区别特征。第四,坏死中普遍存在的下游应答机制是自噬溶酶体的活化。第五点则是线粒体膜电势和内质网应激的缺失。第六,部分坏死样细胞的活性氧自由基浓度会增加,但是ROS的活性氧在坏死的发生及发展中没有发挥关键性作用。第七,细胞的死亡是否能被necrostatin-1(一种特异性的RIP1抑制剂)特异性地抑制。最后,坏死通路激活的重要标志是分子受体相互作用蛋白1(RIPK1)和RIPK3的相互作用和活化,以及混交激酶域蛋白(MLKL)的磷酸化。因此,在病理学上较容易鉴别坏死和凋亡[9]。
调控机制
[编辑]- 第一是肿瘤坏死因子及TNF-R1信号传导通路,而这信号传导通路的关键步骤是RIP1与RIP3的活化和结合,以及RIPK3的相互作用和活化,以及混交激酶域蛋白(MLKL)的磷酸化。在RIP1方面,其N末端的丝氨酸/苏氨酸激酶活性允许其参与坏死的调控[1],因为亲环素D和腺嘌呤核苷酸移位酶二者之间的相互作用被中断,最终因胞内线粒体出现功能障碍而促使坏死的发生[10]。在RIP3方面,其拥有自身磷酸化的激酶活性[11]。TNF-R1在细胞接收到死亡信号后,会激活并将此信号传递至细胞内,而RIP1和RIP3接收到活化信号后,会启动两者的结合并开启RIP1的磷酸化反应。RIP3同时开始自身的磷酸化。已磷酸化的RIP1-RIP3复合物作为坏死通路的关键信号分子,启动下游的信号传导通路,以及MLKL磷酸化和膜结合死亡执行程序,最终发生坏死[12]。
- 第二是RIP1/RIP3信号传导通路。肿瘤坏死因子与TNF-R1在坏死信号的刺激下结合,形成肿瘤坏死因子受体相关死亡域蛋白(TRADD)可以为RIP1激酶提供结合位点。当RIP1加入TRADD后,就会形成膜相关复合物。RIP1在形成膜相关复合物后会被活化,并且与TAK1-TAB2复合物结合,接着IκB 激酶(携带NEMO基因调节亚基)加入此复合物后,会形成更大的聚合物。聚合物中的IκB 激酶因发生磷酸化而促进核因子的释放。TRADD和TRIP1同时间将从膜相关复合物上脱落,而caspase-8、Fas相关死亡域蛋白和RIP3激酶则与膜相关复合物结合,最终形成新的膜相关复合物。在新的膜相关复合物形成后,MLKL作为RIP3的底物,会发生磷酸化并从单体变为寡聚体,接着从细胞质转移到细胞膜,其N末端插入到细胞膜的结构内,并且与膜上的心磷脂和磷脂酰肌醇结合,因形成孔道而释放细胞内的物质,以及钠和钙的内流,最终发生坏死[13][14][15]。
- 第三是PKC-MAPK-AP-1相关的信号传导通路。蛋白激酶C经zVAD的诱导后,激活丝裂原活化蛋白激酶(MAPK)及cJUN氨基末端激酶,过程中会联合细胞外信号调节激酶活化AP-1转录因子(AP-1),令其参与到坏死的调控和信号传导中,并且承担类似于RIP1/RIP3信号传导通路中,重要信号因子NF-κB的角色。
- 第四是ROS相关的代谢调控途径,包括直接方式及间接方式。直接方式即由ROS阻断细胞的能量代谢链,因细胞能量代谢出现障碍而直接引致细胞死亡。间接方式即ROS活化后对细胞器膜产生的损伤效应。在溶酶体及线粒体等重要亚细胞结构受到ROS的损伤而出现通透性的改变后,会导致细胞能量出现障碍和大量溶酶体的释放及活化,诱发细胞的自我消化,从而加速细胞死亡。然而,ROS诱发的细胞死亡是坏死的主要执行程序,还是部分细胞发生的个别死亡现象尚有争议[16],缺乏有说服力的证据来证实。
原因
[编辑]外在因素
[编辑]引起坏死的外部因素包括机械性创伤(对身体的物理损害会导致细胞破裂)、对血管的损害(可能会破坏相关组织的血液供应),以及局部缺血等[17]。由于细胞破裂,极高或极低的温度会导致坏死[17]。在冻伤中,会形成晶体,从而增加剩余组织和液体的压力,继而导致细胞破裂。在极端条件下,组织和细胞会通过对膜和细胞质不受控制的破坏过程而死亡[18] 。
内部因素
[编辑]引起坏死的内部因素包括玻璃体营养不良、神经细胞的损伤和麻痹。胰腺酶(一种脂酶)是脂肪组织坏死的主要原因[17] 。坏死可以被免疫系统的成分激活,例如补体系统、细菌毒素、已活化的自然杀伤细胞,以及腹膜巨噬细胞等[19] 。具有免疫屏障(肠粘膜)的细胞,由病原体诱导的坏死程序,可以减轻病原体通过受炎症影响的表面的入侵[19]。毒素和病原体可能导致坏死,而蛇毒等则可能会抑制酶并导致细胞死亡[17]。大虎头蜂造成的刺伤也会造成坏死性伤口[20]。病理学的特征是细胞因子的分泌不足,而一氧化氮和活性氧类会伴随着细胞的严重坏死性死亡[17]。坏死的一个典型例子是缺血,它导致氧气、葡萄糖和其他营养因子的大量消耗,并且引起内皮细胞和神经元、心肌细胞及肾细胞等周边组织,不增殖细胞的大量坏死性死亡[19] 。有细胞学研究表明,坏死不仅发生于病理事件发生的期间,还是某些生理过程的一部分[17]。由活化所诱导的原发性T淋巴细胞死亡,以及免疫反应的其他重要组成部分并不依赖胱天蛋白酶,并且坏死,故而研究人员已经证明坏死细胞死亡的发生,不仅可以发生在病理过程中,而且可以发生在组织更新、胚胎发育和免疫反应等正常过程中[17] 。
发病机理
[编辑]途径
[编辑]坏死被认为是不受管制的过程[21] ,然而在生物体内可能存在两种广泛的坏死途径[21]。第一种坏死途径最初涉及缺血性细胞死亡及肿瘤浸润,并且发生细胞肿胀,受影响的细胞开始起泡,随后出现固缩现象。最终细胞核溶解到细胞质中,即核溶解[21]。第二种坏死途径在细胞凋亡后发生,明显的细胞变化是细胞核破裂成碎片,即核碎裂[21]。
组织病理学改变
[编辑]坏死的核变化及其变化的特征取决于其DNA分解的方式:
坏死中其他典型的细胞变化包括:
除此之外,在较大的组织学范围内,pseudopalisades(false palisades)是指围绕坏死组织的细胞密集区域,而Pseudopalisading 坏死表明是侵袭性肿瘤[22] 。
治疗
[编辑]坏死的原因很多,故而治疗是基于坏死的产生方式。治疗坏死通常涉及两个不同的过程,通常必须先处理导致坏死的根本原因,然后才能处理死亡组织。
- 清创术是坏死的标准疗法,通过手术或非手术手段清除死亡的组织。根据坏死的严重程度,其范围可能从去除小块皮肤到完全切除受影响的四肢或器官。以化学方法清除坏死组织是另一种选择,其中酶清创剂分为蛋白酶解、纤维蛋白分解及胶原酶,用于靶向死亡组织的各种成分[23]。在某些情况下,采用Lucluc sericata幼虫的蛆疗法可以去除坏死的组织和感染[24]。
- 化学品和有毒物质(例如药物、酸及碱)与皮肤会发生反应,导致皮肤脱落及坏死。因此,治疗包括鉴定和终止使用对皮肤有害的药物,然后治疗伤口(包括预防感染及尽可能使用免疫抑制疗法,例如消炎药或免疫抑制剂等)[26]。以被蛇咬伤后的治疗为例子,使用抗蛇毒血清可以阻止毒素的传播,同时利用抗生素来阻止感染[27]。
即使阻止导致细胞坏死的最初原因后,坏死的组织仍会保留在体内。机体对细胞凋亡的免疫反应(涉及细胞物质的自动分解和再循环),却不会被坏死细胞的死亡所触发的,因为凋亡途径并不能正常运作[28]。
植物
[编辑]如果缺乏钙就不能合成果胶,故而因不能结合细胞壁而阻碍了分生组织,最终导致茎、根尖和叶边缘坏死[29]。例如,由于存在着植物病原体,组织坏死可在阿拉伯芥中发生,而索诺拉沙漠中的仙人掌(如巨人柱和Pachycereus pringlei)等则经常形成坏死的斑块。Drosophila mettleri已经拥有p450排毒系统,使其能够使用这些坏死斑块中释放出来的分泌物来筑巢和喂养幼虫。
另见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 Degterev, A; Hitomi, J; Germscheid, M; Ch'en, IL; Korkina, O; Teng, X; Abbott, D; Cuny, GD; Yuan, C; Wagner, G; Hedrick, SM; Gerber, SA; Lugovskoy, A; Yuan, J. Identification of RIP1 kinase as a specific cellular target of necrostatins.. Nature chemical biology. 2008-05, 4 (5): 313–21 [2020-01-30]. PMID 18408713. doi:10.1038/nchembio.83. (原始内容存档于2020-01-30).
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Kumar V, Abbas AK, Aster JC, Fausto N. Robbins and Cotran pathologic basis of disease 8th. Philadelphia, PA: Saunders/Elsevier. 2010: 12–41. ISBN 978-1416031215.
- ^ 3.0 3.1 3.2 3.3 3.4 Craft J, Gordon C, Tiziani A, Huether SE, McCance KL, Brashers VL. Understanding pathophysiology 1st. Chatswood, N.S.W.: Elsevier Australia. 2010. ISBN 978-0729539517.
- ^ 4.0 4.1 McConnell TH. The nature of disease: pathology for the health professions. Baltimore, Mar.: Lippincott Williams & Wilkins. 2007. ISBN 978-0781753173.
- ^ Sattar. Fundamentals of Pathology 2015th. Chicago, IL: Pathoma LLC. 2015: 5. ISBN 978-0-9832246-2-4.
- ^ 6.0 6.1 Stevens A, Lowe JS, Young B, Deakin PJ. Wheater's basic histopathology: a colour atlas and text 4th. Edinburgh: Churchill Livingstone. 2002. ISBN 978-0443070013.
- ^ Saey, Tina Hesman. Cancer cells self-destruct in blind mole rats. Science News. Society for Science and the Public. 5 November 2012 [27 November 2012]. (原始内容存档于2013-06-19).
- ^ Gorbunova V, Hine C, Tian X, Ablaeva J, Gudkov AV, Nevo E, Seluanov A. Cancer resistance in the blind mole rat is mediated by concerted necrotic cell death mechanism. Proc. Natl. Acad. Sci. U.S.A. 2012, 109 (47): 19392–6. Bibcode:2012PNAS..10919392G. PMC 3511137
 . PMID 23129611. doi:10.1073/pnas.1217211109.
. PMID 23129611. doi:10.1073/pnas.1217211109.
- ^ Degterev, A; Huang, Z; Boyce, M; Li, Y; Jagtap, P; Mizushima, N; Cuny, GD; Mitchison, TJ; Moskowitz, MA; Yuan, J. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury.. Nature chemical biology. 2005-07, 1 (2): 112–9 [2020-01-30]. PMID 16408008. doi:10.1038/nchembio711. (原始内容存档于2020-01-30).
- ^ Temkin, V; Huang, Q; Liu, H; Osada, H; Pope, RM. Inhibition of ADP/ATP exchange in receptor-interacting protein-mediated necrosis.. Molecular and cellular biology. 2006-03, 26 (6): 2215–25 [2020-01-31]. PMID 16507998. doi:10.1128/MCB.26.6.2215-2225.2006. (原始内容存档于2020-01-31).
- ^ X, Sun; J, Lee; T, Navas; Dt, Baldwin; Ta, Stewart; Vm, Dixit. RIP3, a Novel Apoptosis-Inducing Kinase. The Journal of biological chemistry. 1999-06-11 [2020-01-31]. PMID 10358032. (原始内容存档于2020-01-31) (英语).
- ^ Cho, YS; Challa, S; Moquin, D; Genga, R; Ray, TD; Guildford, M; Chan, FK. Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation.. Cell. 2009-06-12, 137 (6): 1112–23 [2020-01-31]. PMID 19524513. doi:10.1016/j.cell.2009.05.037. (原始内容存档于2020-01-31).
- ^ Ea, CK; Deng, L; Xia, ZP; Pineda, G; Chen, ZJ. Activation of IKK by TNFalpha requires site-specific ubiquitination of RIP1 and polyubiquitin binding by NEMO.. Molecular cell. 2006-04-21, 22 (2): 245–57 [2020-01-31]. PMID 16603398. doi:10.1016/j.molcel.2006.03.026. (原始内容存档于2020-01-31).
- ^ Vandenabeele, Peter; Galluzzi, Lorenzo; Vanden Berghe, Tom; Kroemer, Guido. Molecular mechanisms of necroptosis: an ordered cellular explosion. Nature Reviews Molecular Cell Biology. 2010-09-08, 11 (10): 700–714 [2020-01-31]. doi:10.1038/nrm2970. (原始内容存档于2020-12-15).
- ^ Wang, H; Sun, L; Su, L; Rizo, J; Liu, L; Wang, LF; Wang, FS; Wang, X. Mixed lineage kinase domain-like protein MLKL causes necrotic membrane disruption upon phosphorylation by RIP3.. Molecular cell. 2014-04-10, 54 (1): 133–146 [2020-01-31]. PMID 24703947. doi:10.1016/j.molcel.2014.03.003. (原始内容存档于2020-01-31).
- ^ Kim, YS; Morgan, MJ; Choksi, S; Liu, ZG. TNF-induced activation of the Nox1 NADPH oxidase and its role in the induction of necrotic cell death.. Molecular cell. 2007-06-08, 26 (5): 675–87 [2020-01-31]. PMID 17560373. doi:10.1016/j.molcel.2007.04.021. (原始内容存档于2020-01-31).
- ^ 17.0 17.1 17.2 17.3 17.4 17.5 17.6 Raffray M, Cohen GM; Cohen. Apoptosis and necrosis in toxicology: a continuum or distinct modes of cell death?. Pharmacol. Ther. 1997, 75 (3): 153–77. PMID 9504137. doi:10.1016/s0163-7258(97)00037-5.
- ^ Nazarian RM, Van Cott EM, Zembowicz A, Duncan LM. Warfarin-induced skin necrosis. J. Am. Acad. Dermatol. 2009, 61 (2): 325–32. PMID 19615543. doi:10.1016/j.jaad.2008.12.039.
- ^ 19.0 19.1 19.2 Proskuryakov SY, Konoplyannikov AG, Gabai VL. Necrosis: a specific form of programmed cell death?. Exp. Cell Res. 2003, 283 (1): 1–16. PMID 12565815. doi:10.1016/S0014-4827(02)00027-7.
- ^ Yanagawa, Youichi. Cutaneous hemorrhage or necrosis findings after Vespa mandarinia (wasp) stings may predict the occurrence of multiple organ injury: A case report and review of literature. Clinical Toxicology. 10 October 1980, 45 (7): 803–807. PMID 17952752. doi:10.1080/15563650701664871.
- ^ 21.0 21.1 21.2 21.3 Kroemer G, Galluzzi L, Vandenabeele P, Abrams J, Alnemri ES, Baehrecke EH, Blagosklonny MV, El-Deiry WS, Golstein P, Green DR, Hengartner M, Knight RA, Kumar S, Lipton SA, Malorni W, Nuñez G, Peter ME, Tschopp J, Yuan J, Piacentini M, Zhivotovsky B, Melino G, Nomenclature Committee on Cell Death 2009. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009. Cell Death Differ. January 2009, 16 (1): 3–11. PMC 2744427
 . PMID 18846107. doi:10.1038/cdd.2008.150.
. PMID 18846107. doi:10.1038/cdd.2008.150.
- ^ Wippold FJ, Lämmle M, Anatelli F, Lennerz J, Perry A. Neuropathology for the neuroradiologist: palisades and pseudopalisades. AJNR Am J Neuroradiol. 2006, 27 (10): 2037–41. PMID 17110662.
- ^ Singhal A, Reis ED, Kerstein MD. Options for nonsurgical debridement of necrotic wounds. Adv Skin Wound Care. 2001, 14 (2): 96–100; quiz 102–3. PMID 11899913. doi:10.1097/00129334-200103000-00014.
- ^ Horobin AJ, Shakesheff KM, Pritchard DI. Maggots and wound healing: an investigation of the effects of secretions from Lucilia sericata larvae upon the migration of human dermal fibroblasts over a fibronectin-coated surface. Wound Repair Regen. 2005, 13 (4): 422–33. PMID 16008732. doi:10.1111/j.1067-1927.2005.130410.x.
- ^ Eum HA, Cha YN, Lee SM. Necrosis and apoptosis: sequence of liver damage following reperfusion after 60 min ischemia in rats. Biochem. Biophys. Res. Commun. 2007, 358 (2): 500–5. PMID 17490613. doi:10.1016/j.bbrc.2007.04.153.
- ^ Cooper KL. Drug reaction, skin care, skin loss. Crit Care Nurse. 2012, 32 (4): 52–9. PMID 22855079. doi:10.4037/ccn2012340.
- ^ Chotenimitkhun R, Rojnuckarin P; Rojnuckarin. Systemic antivenom and skin necrosis after green pit viper bites. Clin Toxicol. 2008, 46 (2): 122–5. PMID 18259959. doi:10.1080/15563650701266826.
- ^ Edinger AL, Thompson CB; Thompson. Death by design: apoptosis, necrosis and autophagy. Curr. Opin. Cell Biol. 2004, 16 (6): 663–9. PMID 15530778. doi:10.1016/j.ceb.2004.09.011.
- ^ Capon B. Botany for gardeners 3rd. Portland, Or.: Timber Press. 2010. ISBN 978-1-60469-095-8.
