硫化氢
| 硫化氢 | |
|---|---|
| |

| |
| IUPAC名 Hydrogen sulphide | |
| 系统名 Hydrogen sulfide[1] | |
| 别名 | 氢硫酸 |
| 识别 | |
| CAS号 | 7783-06-4 |
| PubChem | 402 |
| ChemSpider | 391 |
| SMILES |
|
| InChI |
|
| InChIKey | RWSOTUBLDIXVET-UHFFFAOYAJ |
| Beilstein | 3535004 |
| Gmelin | 303 |
| 3DMet | B01206 |
| UN编号 | 1053 |
| EINECS | 231-977-3 |
| ChEBI | 16136 |
| RTECS | MX1225000 |
| KEGG | C00283 |
| MeSH | Hydrogen+sulfide |
| 性质 | |
| 化学式 | H2S |
| 摩尔质量 | 34.082 g·mol⁻¹ |
| 外观 | 无色气体 |
| 密度 | 1.363 g/L |
| 熔点 | -82.30 °C (190.85 K) |
| 沸点 | -60.28 °C (212.87 K) |
| 溶解性(水) | 0.25 g/100 mL (40 °C) |
| pKa | 7.0[2][3] |
| 折光度n D |
1.000644 (0 °C)[4] |
| 结构 | |
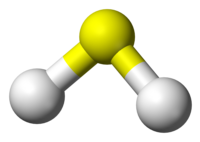
| 分子构型 | 角形 |
| 偶极矩 | 0.97 D |
| 热力学 | |
| ΔfHm⦵298K | −21 kJ mol−1[5] |
| S⦵298K | 206 J mol−1 K−1[5] |
| 热容 | 1.003 J K-1 g-1 |
| 危险性 | |
| 欧盟危险性符号 | |
| 欧盟编号 | 016-001-00-4 |
| H-术语 | H220, H330, H400 |
| P-术语 | P210, P260, P271, P273, P284, P304+340, P310, P320, P377, P381, P391, P403, P403+233, P405 |
| 主要危害 | 剧毒,可燃 |
| NFPA 704 | |
| 闪点 | −82.4 °C(−116.3 °F)[6] |
| 自燃温度 | 232 °C(450 °F) |
| 爆炸极限 | 4.3–46% |
| PEL | C 20 ppm; 50 ppm [10分钟,最高点] [7] |
| 致死量或浓度: | |
LC50(中位浓度)
|
|
LCLo(最低)
|
|
| 相关物质 | |
| 相关氢化物 | 水、硒化氢、碲化氢、钋化氢,磷化氢 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
硫化氢是无机化合物,化学式为H2S。正常是无色、易燃的酸性气体,也是一种氧族元素的氢化物。硫化氢是急性剧毒物质,具有臭鸡蛋味,吸入少量高浓度硫化氢可于短时间内致命。低浓度的硫化氢对眼、呼吸系统及中枢神经都有影响。它有毒,有腐蚀性,还可以被燃烧。[9]
硫化氢通常由有机物在无氧气的原核生物分解的情况下产生,例如在沼泽和下水道中;此过程通常称为厌氧消化,该过程通过还原硫酸盐的微生物完成。H
2S也存在于火山气体,天然气和井水的一些来源中。[10]人体会产生少量的H
2S,用于细胞信号传送。[11]
瑞典化学家卡尔·威廉·舍勒因在1777年发现了硫化氢的化学成分而受到赞誉。
分布
[编辑]硫化氢自然存在于原油、天然气、火山气体和温泉之中。少量的硫化氢在原油中、但天然气可以包含高达90%硫化氢;也可以在细菌于缺氧状态下分解有机物的过程中产生,或者是一部分的腐败海藻中常见。人体释放出的屁含有极小量(少于屁成分的1%)的硫化氢。
制备
[编辑]硫化氢一般是由分离酸气而成,也就是有大量H
2S的天然气。它也可以由氢和液体的硫在450°C下化合而成。碳氢化合物可以作为反应中氢的来源。[12]
实验室一般使用
来制取硫化氢。
也可以用
此方法是利用了活泼金属(碱金属除外)硫化物的水解。硒化铝(灰色)和碲化铝(暗灰色)也能和水迅速反应,生成硒化氢和碲化氢。大部分金属和非金属的硫化物,如:硫化铝、五硫化二磷、二硫化硅遇水都会形成硫化氢。[14]
性质
[编辑]
物理性质
[编辑]2015年,物理学者发现,硫化氢在温度203 K(-70°C)、极度高压的环境下(至少150GPa,也就是约150万标准大气压)会发生超导相变。[来源请求]
化学性质
[编辑]硫化氢比同族的水不稳定,加热高于700K时即发生分解。
硫化氢比空气稍重,硫化氢和空气的混合物极易爆炸。硫化氢和氧气燃烧会产生蓝色火焰,形成二氧化硫和水。在一般化学反应里,硫化氢是一种还原剂,如硫化氢可与二氧化硫反应形成单质硫和水。
硫化氢和二氧化硫即使在液态也会迅速反应。[15]
硫化氢可微溶于水,形成弱酸,称为“氢硫酸”。其水溶液包含了氢硫酸根HS-(在摄氏18度、浓度为0.01-0.1摩/公升的溶液里,pKa=6.9)和离子硫S2-(pKa = 11.96)。一开始清澈的氢硫酸置放一段时间后会变得混浊,这是因为氢硫酸会和溶解在水中的氧起缓慢的反应,产生不溶于水的单质硫。
硫化氢和金属离子接触会形成硫化金属,硫化金属往往是深暗色的。用于检测硫化氢的醋酸铅纸和硫化氢的气体接触时会产生灰色的硫化铅(II)。硫化金属与强酸反应时则会释放出硫化氢。
此外,气态硫化氢和浓硝酸或任何强氧化剂接触时会发生爆炸。[16]与醇反应则形成硫醇。
硫化氢是酸性的,它与碱及一些金属(如银)有化学反应。例如:硫化氢和银接触后,会产生黑褐色的硫化银,如果氧气存在反应趋势更大:
该反应能够进行的原因是硫化银的生成自由能负值很大,增大了正方向反应的趋势。
安全
[编辑]硫化氢是剧毒及易爆气体。硫化氢也是易燃的(爆炸极限,4.3–46%)。它比空气重,容易积聚在通风不良的空间底部。虽然起初很刺鼻(闻起来像臭鸡蛋[17]),它会迅速麻痹嗅觉,因此受害者意识到它的存在时就为时已晚。为了安全处理硫化氢,人们应参考硫化氢的安全数据表。[18]
相对浓度危险度
[编辑]| 浓度(单位:ppm) | 反应 |
|---|---|
| 0.00047 | 气味阈值,指的是50%的人类可以嗅到气味但无法识别是什么的点。[19] |
| 0.41 | 嗅到难闻的气味 |
| 10 | 硫化氢的REL(建议暴露极限),由NIOSH,也就是美国国家职业安全卫生研究所制定。[1] |
| 10 – 20 | 可刺激眼睛的临界浓度。 |
| 20 | OSHA设定的可接受最高浓度[20] |
| 50 | 可接受的最大浓度(持续8小时,最大持续时间为10分钟)[20] |
| 50 - 100 | 气管刺激、结膜炎 伤害眼睛 |
| 100 – 150 | 呼吸几次后,嗅神经瘫痪,嗅觉消失,而且常常伴随着意识的危险。 [21][22] |
| 100 - 200 | 嗅觉麻痹 |
| 200 - 300 | 一小时内急性中毒 |
| 320 – 530 | 会导致肺水肿,可能会死[23] |
| 600 | 一小时内死亡 |
| 530 – 1000 | 会强烈刺激中枢神经系统并加快呼吸,导致呼吸困难。 |
| 800 | 五分钟暴露于这种浓度的人类有一半会死亡 |
| >1000(>0.1%) | 立即丧失呼吸功能,即使是单次呼吸也是如此。 |
自杀
[编辑]通过混合某些家用成分产生的硫化氢气体于2008年在日本因自杀风潮而使用。[24]这波风潮促使东京自杀预防中心的工作人员在黄金周期间设立了专门的热线,因为他们在5月的年度假期期间接到了更多来自想自杀的人的电话。[25]
截至2010年,这种现象已在美国许多城市中发生,提醒那些到达自杀现场的人。[20][26][27][28][29]这些第一批接近自杀者的人们,例如紧急服务人员或家庭成员,有可能因吸入硫化氢气体或被火烧而死亡或受伤。[30][31]地方政府还发起了运动来预防此类自杀。
参见
[编辑]参考文献
[编辑]- ^ 1.0 1.1 Hydrogen Sulfide - PubChem Public Chemical Database. The PubChem Project. USA: National Center for Biotechnology Information. [2020-10-21]. (原始内容存档于2013-12-19).
- ^ Perrin, D.D. Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution 2nd. Oxford: Pergamon Press. 1982.
- ^ Kolthoff, Izaak Maurits; Elving, Philip Juliber. Treatise on analytical chemistry. 1959 [2021-04-27]. ISSN 0082-6251. (原始内容存档于2021-04-27) (英语).
- ^ Patnaik, Pradyot. Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- ^ 5.0 5.1 Zumdahl, Steven S. Chemical Principles 6th. Houghton Mifflin Company. 2009: A23. ISBN 978-0-618-94690-7.
- ^ Hydrogen sulfide. National Pollutant Inventory. [2021-04-27]. (原始内容存档于2021-04-17).
- ^ NIOSH Pocket Guide to Chemical Hazards. #0337. NIOSH.
- ^ 8.0 8.1 Hydrogen sulfide. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ Hydrogen Sulphide In Well Water. [4 September 2018]. (原始内容存档于2021-04-17).
- ^ Bos, Eelke M.; Goor, Harry van; Joles, Jaap A.; Whiteman, Matthew; Leuvenink, Henri G. D. Hydrogen sulfide: physiological properties and therapeutic potential in ischaemia. British Journal of Pharmacology. 2015, 172 (6): 1479–1493 [2021-04-27]. ISSN 1476-5381. PMC 4369258
 . PMID 25091411. doi:10.1111/bph.12869. (原始内容存档于2021-04-29) (英语).
. PMID 25091411. doi:10.1111/bph.12869. (原始内容存档于2021-04-29) (英语).
- ^ Pouliquen, Francois; Blanc, Claude; Arretz, Emmanuel; Labat, Ives; Tournier-Lasserve, Jacques; Ladousse, Alain; Nougayrede, Jean; Savin, Gérard; Ivaldi, Raoul. Hydrogen Sulfide. Wiley-VCH Verlag GmbH & Co. KGaA (编). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2000-06-15: a13_467. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a13_467 (英语).
- ^ 《无机化学》丛书.第二卷.§2.5含Al-S、Al-Se键的化合物及碲化物.P461
- ^ McPherson, William. Laboratory manual. Ginn and Company. 1913 [2020-10-24]. (原始内容存档于2021-04-27) (英语).
- ^ Harlan Preston Guest. Reactions of inorganic compounds with liquid hydrogen sulfide (页面存档备份,存于互联网档案馆). Thesis (Iowa State College), 1930. pp 29.
- ^ 硫化氢 H2S. 大连大特气体有限公司. [2020-07-17]. (原始内容存档于2020-07-17).
- ^ Why Does My Water Smell Like Rotten Eggs?. Minnesota Department of Health. [20 January 2020]. (原始内容存档于2021-04-23).
- ^ Iowa State University, Department of Chemistry MSDS. Hydrogen Sulfide Material Safety Data Sheet (PDF). [2009-03-14]. (原始内容 (PDF)存档于2009-03-27).
- ^ Iowa State University Extension. The Science of Smell Part 1: Odor perception and physiological response (PDF). PM 1963a. May 2004 [2012-06-20]. (原始内容存档 (PDF)于2013-05-03).
- ^ 20.0 20.1 20.2 存档副本 (PDF). [2020-10-24]. (原始内容存档 (PDF)于2020-07-30).[需要完整来源]
- ^ USEPA; Health and Environmental Effects Profile for Hydrogen Sulfide p.118-8 (1980) ECAO-CIN-026A
- ^ Zenz, C.; Dickerson, O.B.; Horvath, E.P. Occupational Medicine. 3rd. St. Louis, MO. 1994: 886.
- ^ Lindenmann, Joerg; Matzi, Veronika; Neuboeck, Nicole; Ratzenhofer-Komenda, Beatrice; Maier, Alfred; Smolle-Juettner, Freyja-Maria. Severe hydrogen sulphide poisoning treated with 4-dimethylaminophenol and hyperbaric oxygen. Diving and Hyperbaric Medicine. 2010-12, 40 (4): 213–217 [2021-04-27]. ISSN 1833-3516. PMID 23111938. (原始内容存档于2021-01-12).
- ^ Dangerous Japanese 'Detergent Suicide' Technique Creeps Into U.S.. Wired. [2021-04-27]. ISSN 1059-1028. (原始内容存档于2021-01-25) (美国英语).
- ^ Namiki, Noriko. Terrible Twist in Japan Suicide Spates. ABC News. 23 May 2008 [2020-10-24]. (原始内容存档于2021-04-17).
- ^ 存档副本 (PDF). [2020-10-24]. (原始内容存档 (PDF)于2021-01-26).[需要完整来源]
- ^ 存档副本 (PDF). [2020-10-24]. (原始内容存档 (PDF)于2020-11-09).[需要完整来源]
- ^ 存档副本 (PDF). [2020-10-24]. (原始内容存档 (PDF)于2021-04-17).[需要完整来源]
- ^ 存档副本 (PDF). [2020-10-24]. (原始内容存档 (PDF)于2020-07-29).[需要完整来源]
- ^ dhmh.maryland.gov 互联网档案馆的存档,存档日期January 3, 2012,.
- ^ Scoville, Dean. Chemical Suicides. POLICE Magazine. April 2011 [2013-12-19]. (原始内容存档于2017-04-27).
扩展阅读
[编辑]- Committee on Medical and Biological Effects of Environmental Pollutants. Hydrogen Sulfide. Baltimore: University Park Press. 1979. ISBN 978-0-8391-0127-7.
- Siefers, Andrea. A novel and cost-effective hydrogen sulfide removal technology using tire derived rubber particles (MS论文). Iowa State University. 2010 [8 February 2013]. (原始内容存档于2021-04-17).
外部链接
[编辑]- International Chemical Safety Card 0165 (页面存档备份,存于互联网档案馆)
- Concise International Chemical Assessment Document 53 (页面存档备份,存于互联网档案馆)
- National Pollutant Inventory - Hydrogen sulfide fact sheet
- NIOSH Pocket Guide to Chemical Hazards (页面存档备份,存于互联网档案馆)
- NACE (National Association of Corrosion Epal) (页面存档备份,存于互联网档案馆)










