無機化學
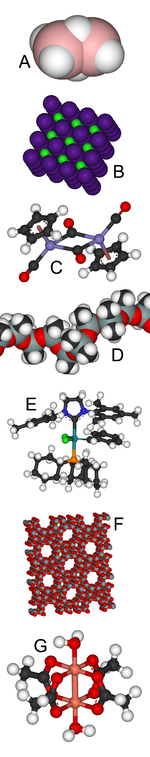
A:乙硼烷中含有不尋常的三中心兩電子鍵。
B:氯化銫的晶體結構是一類結構的代表。
C:Fp2是一個有機金屬雙核簇合物。
D:矽氧樹脂在隆胸技術和橡皮泥中都有應用。
E:格拉布催化劑的發現者憑此獲得了2005年的諾貝爾化學獎。
F:沸石是分子篩的一種重要類型。
G:乙酸銅異常的逆磁性質為理論化學增添了新的動力。
無機化學是研究無機化合物的化學分支學科。通常,無機化合物與有機化合物相對,指不含C-H鍵的化合物,因此一氧化碳、二氧化碳、二硫化碳、氰化物、硫氰酸鹽、碳酸及碳酸鹽等都屬於無機化學研究的範疇。但這二者界限並不嚴格,之間有較大的重疊,有機金屬化學即是一例。
歷史
[編輯]由於在有機化學發展初期,所有有機化合物(如尿素和尿酸等)都是從生物體內取得的,而且它們的性質類似,因此取「有機化學」作為其名稱。其中的「機」字帶有「機體」,「身體」的意思。而與之相對便誕生了「無機化學」,用以指研究非生物體化合物的化學,當時主要包含從礦物如雄黃和方鉛礦中製得的化合物。然而,隨着1828年弗里德里希·維勒成功由無機的氰酸銨合成了其同分異構體:有機的尿素,以是否為生物體來源作為區分有機無機化合物的標準便被打破[1],取而代之的是依性質上的不同來區分這二者。儘管現在有機化學仍主要是研究含碳化合物的化學,而無機化學主要是研究不含碳化合物的化學,但是這兩者都已經超越了以上的限制,例如:
- 無機含碳的化合物有:二元碳氧化物、碳酸、二元碳硫化物、金屬羰基化合物、碳鹵化物、氰化物、氰酸鹽、異氰酸鹽、雷酸鹽、硫氰酸鹽、碳化物、光氣、硫光氣、簡單的鹵代和氰代烴,以及諸如三甲基胂之類的有機金屬化合物等。而
- 有機不含碳的化合物有:很多13-17族的與烷烴類似的元素氫化物及衍生物,尤其是矽烷和肼及其相應的衍生物。
基本概念
[編輯]
許多無機化合物是離子化合物,由陽離子和陰離子以離子鍵結合。像氯化鎂其中有鎂離子及氯離子,或是氧化鈉其中有鈉離子及氧離子。任何一種鹽類,其陰離子和陽離子均維持在一定的比例,使得化合物呈電中性。離子可以依其氧化數來描述,而形成離子的難易程度則依對應元素的電離能(陽離子)或電子親合能(陰離子)來表示。
無機鹽類中重要的有氧化物、碳酸鹽、硫酸鹽及鹵化物等。無機鹽類一般有很高的熔點,在固態時多半不是電的良導體,其他的特徵包括對水的溶解度(參見溶解性表)及容易結晶的程度。不過有些無機鹽類(像氯化鈉)可以在水中溶解,有些(像二氧化矽)則不行。
最簡單的無機化學反應為複分解反應,在混合二種鹽類時,其離子互換,但氧化態不變。在氧化還原反應中,還原劑的氧化態增加,而氧化劑的氧化態降低。淨反應是電子的轉移。電子的轉移也可以以間接的方式產生,例如在電池中的反應一様,這也是電化學的基礎概念。
當反應物中有可以解離的氫離子時,會產生交換質子(氫離子)的酸鹼反應。釋放質子的是酸,接收質子的是鹼。路易士酸鹼理論是較廣義的酸鹼定義,其中可以和電子對結合的稱為路易士酸,可以提供電子對的稱為路易士鹼。軟硬酸鹼理論除了將化合物分為酸和鹼,也依極化程度及離子大小來分類[2]。
自然界中許多的無機化合物都是礦物。像土壤中含有氧化鐵(黃鐵礦)及硫酸鈣(石膏)。許多無機化合物也是生物分子,有許多不同的作用,例如電解質(氯化鈉)及結構(像DNA中的多磷酸結構)。
第一個重要的人造化合物是硝酸銨,利用哈柏法製備。許多無機化合物可作為觸媒(像五氧化二釩及三氯化鈦)或是有機化學中的反應物,像氫化鋁鋰。
無機化學的分支包括有機金屬化學、原子簇化學及生物無機化學。這些也是無機化學的熱門研究領域,主要要找到新的觸媒、超導體及藥物。
合成方法
[編輯]無機化合物的合成方法大多數都採用以下方式:
無機化合物
[編輯]無機化合物常會因性質的不同而被分到不同的類別,有時是以化合物最重元素在元素周期表中的位置,有時則以該化合物與其它在結構上的相似性來分類。但這些分類並不是絕對的,它們之間有重疊。
配位化合物
[編輯]
以經典配位化學理論的角度來看,主族元素構成的配體(如、、Cl−、CN−)向金屬原子貢獻一對電子,形成配位鍵從而構成配位化合物。而在現代的配位化合物中,幾乎所有無機和有機化合物都可以被作為配體,從某種意義上也可以將所有的化合物都歸到配位化合物的範疇中,經典理論中的「金屬」在這裏通常是3到13族元素及鑭系和錒系金屬。
配位化合物的異構現象十分普遍。維爾納在1914年合成並且而後光學拆分的Hexol()是第一個不含碳的手性化合物,[3] 而相關的領域被稱為超分子配位化學。[4]
例* 子:[Co(EDTA)]−、[Co(NH3)6]3+、TiCl4(THF)2。
主族元素化合物
[編輯]
主族元素化合物主要指1-2族(除氫之外)和13-18族元素形成的化合物,有時3族的Sc、Y和La及12族的Zn、Cd和Hg也因為反應性類似而被包含在內。[5]
很多主族元素化合物自從化學被發現之初便被研究,例如很多單質硫、白磷和氧氣的二元化合物,以及卡爾·博施和弗里茨·哈伯在二十世紀初發明的合成氨技術更是極大地激勵了無機合成化學的發展。
典型的主族元素化合物有:SiO2、SnCl4和N2O。它們之中有很多都可被歸為「有機金屬化合物」的範疇,例如B(CH3)3,由於其分子中含有有機基團的緣故。很多主族元素化合物也存在於自然界中——例如體液中的離子、DNA中的磷酸基團以及許多酶中的中心金屬原子,而它們也因此被劃在「生物無機化學」的範圍之下。相反地,某些缺少氫的有機化合物也可被劃分為無機化合物,比如富勒烯、碳納米管和二元碳氧化物。
過渡金屬化合物
[編輯]
過渡金屬化合物包含的是4-11族元素所形成的化合物。儘管有時也會考慮3族和12族的元素,但一般主要認為它們屬於主族元素化合物的範疇。
過渡金屬配合傾向很強,其化合物構型也有很大不同,從鈦的四面體型(例如)到鈷配合物的八面體型,再到某些鎳配合物的平面正方結構。很多過渡金屬化合物是重要的生物分子,比如血紅素中的鐵。
有機金屬化合物
[編輯]
一般把有機金屬化合物定義為含有M-C-H鍵的化合物,[6] 其中的金屬M既可以是主族元素,也可以是過渡金屬。但在很多情況下有機金屬化合物的範圍被延伸,高度親脂的金屬羰基化合物和金屬醇鹽也被包含在內。
有機金屬化合物之所以被單獨歸為一類,是因為它們中的有機基團對於氧化和水解較為敏感,且製備方法也較經典的配位化合物苛刻。很多包含弱配位能力配體(如烴類、H2和N2)的配位化合物,也成功在低配位能力溶劑中製得。
由於配體常是石化工業中的材料而且這一類化合物性質獨特,有機金屬化學近年來發展很快,一些例子有:
原子簇化合物
[編輯]

M
原子簇化合物存在於各類化合物中,通常被定義為:凡以3個或3個以上原子直接鍵合構成的多面體或籠為核心,連接外圍原子或基團而形成的結構單元。[7]
生物無機化合物
[編輯]固相化合物
[編輯]有關固相化合物的研究以其材料的結構[8]、鍵結以及物理性質為主。在實務上,固相無機化學使用像晶體學的技術來 了解固體的性質,而這些性質是固體中的許多小單位互相作用的結果。金屬、合金及金屬互化物都包括在固相化合物的研究內容中。相關的研究領域包括凝聚態物理學、冶金學及材料科學。
理論無機化學
[編輯]以原子的玻爾行星模型為起始,現在的理論無機化學以理論化學和計算化學作為基礎,通過定量、半定量的計算或定性分析,得出複雜分子所應具有的性質。由於多電子體系的精確量子力學計算較困難,包括分子軌道理論和配位場理論等的半定量和半實驗的方法,及密度泛函理論之類的近似方法都被應用於理論無機化學中。
除理論外,定量和定性兩個概念對該領域的發展起到至關重要的作用。譬如根據晶體場理論,CuII2(OAc)4(H2O)2含有兩個未成對電子,應為順磁性,但事實上它在室溫下幾乎是逆磁性的。定性理論和實驗之間的矛盾導致了「磁性耦合」這一概念的誕生。因此它不僅推進了自身領域的發展,也帶動了新材料和新科技的誕生。
定性理論
[編輯]
定性理論只需很少的量子力學基礎,對於理解無機化學有很大作用。對於主族元素,價層電子對互斥理論(VSEPR)可以較好地預測分子形狀,比如它可以解釋為何NH3是三角錐型,而則為T型。對於過渡元素,晶體場理論可以幫助理解簡單配合物的構型和磁性,例如為何[FeIII(CN)6]3−離子只有一個未成對電子,而離子則有五個未成對電子。定性理論中尤其重要的概念是電子計數,通過計算中心原子的價電子數,從而得出化合物的結構和反應性。
分子對稱性與群論
[編輯]
無機化學的中心結構是分子對稱性理論[9]。數學中的群論提供了合適的語言依據點群對稱性來描述分子的形狀。群論也使得理論計算得以簡化和因子化。
熱力學和無機化學
[編輯]研究無機化學的另一種方法是關注反應的能量。比如氧化還原電位,酸性,相變等。,其亦屬於物理化學範疇,基礎為熱力學三大定律。
動力學的無機化學
[編輯]無機化學的一個重要的也是日受關注的方面是研究反應途徑。
參考文獻
[編輯]- ^ 人工合成尿素开创者 维勒. 新浪讀書. [2013-10-25]. (原始內容存檔於2020-11-11).
- ^ 1.2.7 硬软酸碱理论(HSAB理论). 福建師範大學網絡教育學院. [2013-10-25].[永久失效連結]
- ^ A. Werner, H. Kuh, P. Wust. Ber. 1914, 47, 196
- ^ Lehn, J. M., Supramolecular Chemistry: Concepts and Perspectives, VCH: Weinhiem, 1995.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Ed.), Oxford:Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ C. Elschenbroich, A. Salzer 」Organometallics : A Concise Introduction」 (2nd Ed) (1992); Wiley-VCH: Weinheim. ISBN 978-3-527-28165-7
- ^ 張季爽、申成主編,湖南大學化學化工學院組編。《基礎結構化學》第二版。北京:科學出版社。ISBN 7-03-016425-2
- ^ Wells, A.F. Structural Inorganic Chemistry. Oxford: Clarendon Press. 1984.
- ^ Cotton, F. A. Chemical Applications of Group Theory 3rd. New York: John Wiley & Sons. 1990. ISBN 978-0471510949.
外部連結
[編輯]- 常見無機化學期刊的連結 (頁面存檔備份,存於互聯網檔案館)(英文)










![{\displaystyle {\ce {[Co((OH)2Co(NH3)4)3]^6+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c39d8d38aea23dc1302f9ecdfa8437ed88446ba1)









![{\displaystyle {\ce {Pd[P(C6H5)3]4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af43514a770a23c725261cc7e1b103d00371eb12)

![{\displaystyle {\ce {[Fe^{III}(H2O)6]^{3+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a557dae9709041cb0f4de56fe17ab35fa6a8e677)