
此條目的主題是氫原子的物理性質。關於氫元素的化學性質,請見「
氫」。
氫原子是氫元素的原子。電中性的原子含有一個正價的質子與一個負價的電子,被庫侖定律束縛於原子核內。在大自然中,氫原子是豐度最高的同位素,稱為氫,氫-1 ,或氕[1]。氫原子不含任何中子,別的氫同位素含有一個或多個中子。這條目主要描述氫-1 。
氫原子擁有一個質子和一個電子,是一個的簡單的二體系統。系統內的作用力只跟二體之間的距離有關,是反平方連心力,不需要將這反平方連心力二體系統再加理想化,簡單化。描述這系統的(非相對論性的)薛定諤方程式有解析解,也就是說,解答能以有限數量的常見函數來表達。滿足這薛定諤方程式的波函數可以完全地描述電子的量子行為。因此可以這樣說,在量子力學裏,沒有比氫原子問題更簡單,更實用,而又有解析解的問題了。所推演出來的基本物理理論,又可以用簡單的實驗來核對。所以,氫原子問題是個很重要的問題。
另外,理論上薛定諤方程式也可用於求解更複雜的原子與分子。但在大多數的案例中,皆無法獲得解析解,而必須藉用電腦來進行計算與模擬,或者做一些簡化的假設,方能求得問題的解析解。
 大多數氫原子的結構。
大多數氫原子的結構。
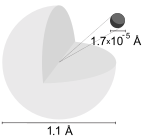 氫原子的半徑大約為玻爾半徑。
氫原子的半徑大約為玻爾半徑。
1913 年,尼爾斯·玻耳在做了一些簡化的假設後,計算出氫原子的光譜頻率。這些假想,玻爾模型的基石,並不是完全的正確,但是可以得到正確的能量答案。
1925/26 年,埃爾文·薛定諤應用他發明的薛定諤方程式,以嚴謹的量子力學分析,清楚地解釋了玻爾答案正確的原因。氫原子的薛定諤方程式的解答是一個解析解,也可以計算氫原子的能級與光譜譜線的頻率。薛定諤方程式的解答比玻爾模型更為精確,能夠得到許多電子量子態的波函數(軌態),也能夠解釋化學鍵的各向異性。
氫原子問題的薛定諤方程式為[2]:131-145:
 ;
;
其中, 是約化普朗克常數,
是約化普朗克常數, 是電子與原子核的約化質量,
是電子與原子核的約化質量, 是量子態的波函數,
是量子態的波函數, 是能量,
是能量, 是庫侖位勢:
是庫侖位勢:
 ;
;
其中, 是真空電容率,
是真空電容率, 是單位電荷量,
是單位電荷量, 是電子離原子核的距離。
是電子離原子核的距離。
採用球坐標  ,將拉普拉斯算子展開:
,將拉普拉斯算子展開:
![{\displaystyle -{\frac {\hbar ^{2}}{2\mu r^{2}}}\left\{{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial }{\partial r}}\right)+{\frac {1}{\sin ^{2}\theta }}\left[\sin \theta {\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial }{\partial \theta }}\right)+{\frac {\partial ^{2}}{\partial \phi ^{2}}}\right]\right\}\psi -{\frac {e^{2}}{4\pi \epsilon _{0}r}}\psi =E\psi }](https://wikimedia.org/api/rest_v1/media/math/render/svg/02941e2abb203eb5d51c0e5251972d4ba37fc516) 。
。
猜想這薛定諤方程式的波函數解  是徑向函數
是徑向函數  與球諧函數
與球諧函數  的乘積:
的乘積:
 。
。
參數為天頂角和方位角的球諧函數,滿足角部分方程式[2]:160-170:
![{\displaystyle -{\frac {1}{\sin ^{2}\theta }}\left[\sin \theta {\frac {\partial }{\partial \theta }}{\Big (}\sin \theta {\frac {\partial }{\partial \theta }}{\Big )}+{\frac {\partial ^{2}}{\partial \phi ^{2}}}\right]Y_{lm}(\theta ,\phi )=l(l+1)Y_{lm}(\theta ,\phi )}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dd400bacbaaa42d613d3fd3156fda00fbc0ee0a) ;
;
其中,非負整數  是軌角動量的角量子數。磁量子數
是軌角動量的角量子數。磁量子數  (滿足
(滿足  )是軌角動量對於 z-軸的(量子化的)投影。不同的
)是軌角動量對於 z-軸的(量子化的)投影。不同的  與
與  給予不同的軌角動量函數解答
給予不同的軌角動量函數解答  :
:
 ;
;
其中, 是虛數單位,
是虛數單位, 是伴隨勒讓德多項式,用方程式定義為
是伴隨勒讓德多項式,用方程式定義為
 ;
;
而  是
是  階勒讓德多項式,可用羅德里格公式表示為:
階勒讓德多項式,可用羅德里格公式表示為:
 。
。
徑向函數滿足一個一維薛定諤方程式:[2]:145-157
![{\displaystyle \left[-{\hbar ^{2} \over 2\mu r^{2}}{d \over dr}\left(r^{2}{d \over dr}\right)+{\hbar ^{2}l(l+1) \over 2\mu r^{2}}-{\frac {e^{2}}{4\pi \epsilon _{0}r}}\right]R_{nl}(r)=ER_{nl}(r)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a4deceed3e94344bdd4ac22fcf4fdc73f36743b) 。
。
方程式左邊的第二項可以視為離心力位勢,其效應是將徑向距離拉遠一點。
除了量子數  與
與  以外,還有一個主量子數
以外,還有一個主量子數  。為了滿足
。為了滿足  的邊界條件,
的邊界條件, 必須是正值整數,能量也離散為能級
必須是正值整數,能量也離散為能級 ![{\displaystyle E_{n}=-\left({\frac {\mu e^{4}}{32\pi ^{2}\epsilon _{0}^{2}\hbar ^{2}}}\right){\frac {1}{n^{2}}}={\frac {-13.6}{n^{2}}}\ [eV]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f26c33e2487fc04c5ee53674126e29ba0f0eb544) 。隨着量子數的不同,函數
。隨着量子數的不同,函數  與
與  都會有對應的改變。按照慣例,規定用波函數的下標符號來表示這些量子數。這樣,徑向函數可以表達為
都會有對應的改變。按照慣例,規定用波函數的下標符號來表示這些量子數。這樣,徑向函數可以表達為
 ;
;
其中, 。
。  近似於玻爾半徑
近似於玻爾半徑  。假若,原子核的質量是無限大的,則
。假若,原子核的質量是無限大的,則  ,並且,約化質量等於電子的質量,
,並且,約化質量等於電子的質量, 。
。  是廣義拉蓋爾多項式,其定義式可在條目拉蓋爾多項式裏找到。
是廣義拉蓋爾多項式,其定義式可在條目拉蓋爾多項式裏找到。
廣義拉蓋爾多項式 另外還有一種在量子力學裏常用的定義式(兩種定義式不同):[2]:152
另外還有一種在量子力學裏常用的定義式(兩種定義式不同):[2]:152
 ;
;
其中, 是拉蓋爾多項式,可用羅德里格公式表示為
是拉蓋爾多項式,可用羅德里格公式表示為
 。
。
為了要結束廣義拉蓋爾多項式的遞迴關係,必須要求量子數  。
。
按照這種定義式,徑向函數表達為
![{\displaystyle R_{nl}(r)={\sqrt {{\left({\frac {2}{na_{\mu }}}\right)}^{3}{\frac {(n-l-1)!}{2n[(n+l)!]^{3}}}}}e^{-r/{na_{\mu }}}\left({\frac {2r}{na_{\mu }}}\right)^{l}L_{n-l-1}^{2l+1}({\tfrac {2r}{na_{\mu }}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5827d99ea58030f72adeab305b29edf3188a6544) 。
。
知道徑向函數  與球諧函數
與球諧函數  的形式,可以寫出整個量子態的波函數,也就是薛定諤方程式的整個解答:
的形式,可以寫出整個量子態的波函數,也就是薛定諤方程式的整個解答:
 。
。
量子數  、
、 、
、 ,都是整數,容許下述值:[2]:165-166
,都是整數,容許下述值:[2]:165-166
 ,
, ,
, 。
。
每一個原子軌態都有特定的角動量向量  。它對應的算符是一個向量算符
。它對應的算符是一個向量算符  。角動量算符的平方
。角動量算符的平方  的本徵值是[2]:160-164
的本徵值是[2]:160-164
 。
。
角動量向量對於任意方向的投影是量子化的。設定此任意方向為 z-軸的方向,則量子化公式為
 。
。
因為 ![{\displaystyle [{\hat {L}}^{2},\ {\hat {L}}_{z}]=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb51a1acfae6e02e56c96435f75a9442efda165d) ,
, 與
與  是對易的,
是對易的, 與
與  彼此是相容可觀察量,這兩個算符有共同的本徵態。根據不確定性原理,可以同時地測量到
彼此是相容可觀察量,這兩個算符有共同的本徵態。根據不確定性原理,可以同時地測量到  與
與  的同樣的本徵值。
的同樣的本徵值。
由於 ![{\displaystyle [{\hat {L}}_{x},\ {\hat {L}}_{y}]=i\hbar {\hat {L}}_{z}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b2033d631790c7702d46a06218927ee0b071503) ,
, 與
與  互相不對易,
互相不對易, 與
與  彼此是不相容可觀察量,這兩個算符絕對不會有共同的基底量子態。一般而言,
彼此是不相容可觀察量,這兩個算符絕對不會有共同的基底量子態。一般而言, 的本徵態與
的本徵態與  的本徵態不同。
的本徵態不同。
給予一個量子系統,量子態為  。對於可觀察量算符
。對於可觀察量算符  ,所有本徵值為
,所有本徵值為  的本徵態
的本徵態  ,形成了一組基底量子態。量子態
,形成了一組基底量子態。量子態  可以表達為這基底量子態的線性組合:
可以表達為這基底量子態的線性組合: 。對於可觀察量算符
。對於可觀察量算符  ,所有本徵值為
,所有本徵值為  的本徵態
的本徵態  ,形成了另外一組基底量子態。量子態
,形成了另外一組基底量子態。量子態  可以表達為這基底量子態的線性組合:
可以表達為這基底量子態的線性組合: 。
。
假若,測量可觀察量  ,得到的測量值為其本徵值
,得到的測量值為其本徵值  ,則量子態機率地塌縮為本徵態
,則量子態機率地塌縮為本徵態  。假若,立刻再測量可觀察量
。假若,立刻再測量可觀察量  ,得到的答案必定是
,得到的答案必定是  ,在很短的時間內,量子態仍舊處於
,在很短的時間內,量子態仍舊處於  。可是,假若改為立刻測量可觀察量
。可是,假若改為立刻測量可觀察量  ,則量子態不會停留於本徵態
,則量子態不會停留於本徵態  ,而會機率地塌縮為
,而會機率地塌縮為  本徵值是
本徵值是  的本徵態
的本徵態  。這是量子力學裏,關於測量的一個很重要的特性。
。這是量子力學裏,關於測量的一個很重要的特性。
根據不確定性原理,
![{\displaystyle \Delta L_{x}\ \Delta L_{y}\geq \left|{\frac {\langle [{\hat {L}}_{x},\ {\hat {L}}_{y}]\rangle }{2i}}\right|={\frac {\hbar |\langle {\hat {L}}_{z}\rangle |}{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e990a8857242d9bac15d603586e7633956e84892) 。
。
 的不確定性與
的不確定性與  的不確定性的乘積
的不確定性的乘積  ,必定大於或等於
,必定大於或等於  。
。
類似地, 與
與  之間,
之間, 與
與  之間,也有同樣的特性。
之間,也有同樣的特性。
電子的總角動量必須包括電子的自旋。在一個真實的原子裏,因為電子環繞着原子核移動,會感受到磁場。電子的自旋與磁場產生作用 ,這現象稱為自旋-軌道作用。當將這現象納入計算,自旋與角動量不再是保守的,可以將此想像為電子的進動。為了維持保守性,必須取代量子數  、
、 與自旋的投影
與自旋的投影  ,而以量子數
,而以量子數  ,
, 來計算總角動量。[2]:271-275
來計算總角動量。[2]:271-275
在原子物理學裏,因為一階相對論性效應,與自旋-軌道耦合,而產生的原子譜線分裂,稱為精細結構。[2]:271-275
非相對論性、無自旋的電子產生的譜線稱為「粗略結構」。氫原子的粗略結構只跟主量子數  有關。可是,更精確的模型,考慮到相對論效應與自旋-軌道效應,能夠分解能級的簡併,使譜線能更精細地分裂。相對於粗略結構,精細結構是一個
有關。可是,更精確的模型,考慮到相對論效應與自旋-軌道效應,能夠分解能級的簡併,使譜線能更精細地分裂。相對於粗略結構,精細結構是一個  效應;其中,
效應;其中, 是精細結構常數。
是精細結構常數。
在相對論量子力學裏,狄拉克方程式可以用來計算電子的波函數。用這方法,能階跟主量子數  、總量子數
、總量子數  有關[3][4],容許的能量為:
有關[3][4],容許的能量為:
![{\displaystyle E_{nj}=E_{n}\left[1+\left({\frac {\alpha }{n}}\right)^{2}\left({\frac {1}{j+{\frac {1}{2}}}}-{\frac {3}{4n}}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5148a765754378dcbda1a7c7a27fab3d2bc7f163) 。
。
 電子的機率密度繪圖。橫向展示不同的角量子數 (l) ,豎向展示不同的能級 (n) 。
電子的機率密度繪圖。橫向展示不同的角量子數 (l) ,豎向展示不同的能級 (n) 。
右圖顯示出能量最低的幾個氫原子軌態(能量本徵函數)。這些是機率密度的截面的繪圖。圖內各種顏色的亮度代表不同的機率密度(黑色:0 機率密度,白色:最高機率密度)。角量子數 ( ) ,以通常的光譜學代碼規則,標記在每一個縱排的最上端。
) ,以通常的光譜學代碼規則,標記在每一個縱排的最上端。 意指
意指  ,
, 意指
意指  ,
, 意指
意指  。主量子數
。主量子數  標記在每一個橫排的最右端。磁量子數
標記在每一個橫排的最右端。磁量子數  被設定為 0 。截面是 xz-平面( z-軸是縱軸)。將繪圖繞着 z-軸旋轉,則可得到三維空間的機率密度。
被設定為 0 。截面是 xz-平面( z-軸是縱軸)。將繪圖繞着 z-軸旋轉,則可得到三維空間的機率密度。
基態是最低能級的量子態,也是電子最常找到的量子態,標記為  態,
態, 。
。
特別注意,在每一個軌態的圖片內,黑線出現的次數。這些二維空間黑線,在三維空間裏,是節面 (nodal plane) 。節面的數量等於  ,是徑向節數(
,是徑向節數(  )與角節數(
)與角節數(  )的總和。
)的總和。
思考氫原子穩定性問題,應用經典電動力學來分析,則由於庫侖力作用,束縛電子會被原子核吸引,呈螺線運動掉入原子核,同時輻射出無窮大能量,因此原子不具有穩定性。但是,在大自然裏這虛擬現象實際並不會發生。那麼,為什麼氫原子的束縛電子不會掉入原子核裏?應用量子力學,可以計算出氫原子系統的基態能量大於某有限值,稱這結果為滿足「第一種穩定性條件」,即氫原子的基態能量  大於某有限值:[5]:10
大於某有限值:[5]:10
 。
。
量子力學的海森堡不確定性原理  可以用來啟發性地說明這問題,電子越接近原子核,電子動能越大。但是海森堡不確定性原理不能嚴格給出數學證明,有些特別案例不能滿足第一種穩定性條件,因為
可以用來啟發性地說明這問題,電子越接近原子核,電子動能越大。但是海森堡不確定性原理不能嚴格給出數學證明,有些特別案例不能滿足第一種穩定性條件,因為  量度的是波函數的半寬度,而不是波函數集聚於原子核附近的程度,所以波函數可以擁有一定的半寬度,並且極度集聚於原子核附近,造成庫侖位能趨於
量度的是波函數的半寬度,而不是波函數集聚於原子核附近的程度,所以波函數可以擁有一定的半寬度,並且極度集聚於原子核附近,造成庫侖位能趨於  ,同時維持有限的動能。
,同時維持有限的動能。
更詳細分析起見,只考慮類氫原子系統,給定原子的原子序  ,原子的能量
,原子的能量  為[註 1]
為[註 1]
 ;
;
其中, 為動能,
為動能, 為位能,
為位能, 為描述類氫原子系統的波函數,
為描述類氫原子系統的波函數, 為位置坐標,
為位置坐標, 為積分體積。
為積分體積。
應用索博列夫不等式,經過一番運算,可以得到能量最大下界為。[6]
![{\displaystyle E_{0}=-4Z^{2}/3\ [Ry]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4e985d936f42c18762d4ad612a9c4345f545e9a) ;
;
其中, 是能量單位芮得柏,大約為13.6eV。
是能量單位芮得柏,大約為13.6eV。
總結,類氫原子滿足第一種穩定性條件這結果。
- ^ 為了方便運算,採用
 、質量
、質量  、基本電荷
、基本電荷  的單位制。
的單位制。
















![{\displaystyle -{\frac {\hbar ^{2}}{2\mu r^{2}}}\left\{{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial }{\partial r}}\right)+{\frac {1}{\sin ^{2}\theta }}\left[\sin \theta {\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial }{\partial \theta }}\right)+{\frac {\partial ^{2}}{\partial \phi ^{2}}}\right]\right\}\psi -{\frac {e^{2}}{4\pi \epsilon _{0}r}}\psi =E\psi }](https://wikimedia.org/api/rest_v1/media/math/render/svg/02941e2abb203eb5d51c0e5251972d4ba37fc516)




![{\displaystyle -{\frac {1}{\sin ^{2}\theta }}\left[\sin \theta {\frac {\partial }{\partial \theta }}{\Big (}\sin \theta {\frac {\partial }{\partial \theta }}{\Big )}+{\frac {\partial ^{2}}{\partial \phi ^{2}}}\right]Y_{lm}(\theta ,\phi )=l(l+1)Y_{lm}(\theta ,\phi )}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dd400bacbaaa42d613d3fd3156fda00fbc0ee0a)










![{\displaystyle \left[-{\hbar ^{2} \over 2\mu r^{2}}{d \over dr}\left(r^{2}{d \over dr}\right)+{\hbar ^{2}l(l+1) \over 2\mu r^{2}}-{\frac {e^{2}}{4\pi \epsilon _{0}r}}\right]R_{nl}(r)=ER_{nl}(r)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a4deceed3e94344bdd4ac22fcf4fdc73f36743b)


![{\displaystyle E_{n}=-\left({\frac {\mu e^{4}}{32\pi ^{2}\epsilon _{0}^{2}\hbar ^{2}}}\right){\frac {1}{n^{2}}}={\frac {-13.6}{n^{2}}}\ [eV]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f26c33e2487fc04c5ee53674126e29ba0f0eb544)












![{\displaystyle R_{nl}(r)={\sqrt {{\left({\frac {2}{na_{\mu }}}\right)}^{3}{\frac {(n-l-1)!}{2n[(n+l)!]^{3}}}}}e^{-r/{na_{\mu }}}\left({\frac {2r}{na_{\mu }}}\right)^{l}L_{n-l-1}^{2l+1}({\tfrac {2r}{na_{\mu }}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5827d99ea58030f72adeab305b29edf3188a6544)









![{\displaystyle [{\hat {L}}^{2},\ {\hat {L}}_{z}]=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb51a1acfae6e02e56c96435f75a9442efda165d)




![{\displaystyle [{\hat {L}}_{x},\ {\hat {L}}_{y}]=i\hbar {\hat {L}}_{z}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b2033d631790c7702d46a06218927ee0b071503)














![{\displaystyle \Delta L_{x}\ \Delta L_{y}\geq \left|{\frac {\langle [{\hat {L}}_{x},\ {\hat {L}}_{y}]\rangle }{2i}}\right|={\frac {\hbar |\langle {\hat {L}}_{z}\rangle |}{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e990a8857242d9bac15d603586e7633956e84892)







![{\displaystyle E_{nj}=E_{n}\left[1+\left({\frac {\alpha }{n}}\right)^{2}\left({\frac {1}{j+{\frac {1}{2}}}}-{\frac {3}{4n}}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5148a765754378dcbda1a7c7a27fab3d2bc7f163)























![{\displaystyle E_{0}=-4Z^{2}/3\ [Ry]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4e985d936f42c18762d4ad612a9c4345f545e9a)



