氯化鉍
外觀
| 氯化鉍 | |
|---|---|

| |

| |
| IUPAC名 Bismuth chloride | |
| 識別 | |
| CAS號 | 7787-60-2 |
| PubChem | 24591 |
| ChemSpider | 22993 |
| SMILES |
|
| InChI |
|
| InChIKey | JHXKRIRFYBPWGE-DFZHHIFOAJ |
| RTECS | EB2690000 |
| 性質 | |
| 化學式 | BiCl3 |
| 摩爾質量 | 315.34 g·mol⁻¹ |
| 外觀 | 吸濕性白色至黃色晶體 |
| 密度 | 4.75 g/cm3 |
| 熔點 | 227 °C(500 K) |
| 沸點 | 447 °C(720 K) |
| 溶解性(水) | 水解生成BiOCl |
| 溶解性 | 溶於甲醇,乙醚,丙酮 |
| 熱力學 | |
| ΔfHm⦵298K | -1.202 kJ/g |
| 熱容 | 0.333 J/(g K) |
| 危險性 | |
| MSDS | JT Baker |
| NFPA 704 | |
| 致死量或濃度: | |
LD50(中位劑量)
|
3324 mg/kg, 口服(大鼠) |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氯化鉍化學式BiCl3,常溫下是易潮解的白色晶體。與離子晶體三氟化鉍不同,在氣相或晶體中,氯化鉍分子構型都為三角錐形,可從價層電子對互斥理論(VSEPR)解釋。是常用的提供Bi3+離子的試劑。氯化鉍是常用的提供Bi3+離子的試劑,以及用於製備其它鉍鹽,以用於顏料和化妝品。
製備
[編輯]氯化鉍可從氯氣與鉍直接反應製得:
- 2 Bi + 3 Cl2 → 2 BiCl3
- Bi2O3 + 6 HCl → 2 BiCl3 + 3 H2O
- Bi + 6 HNO3 → Bi(NO3)3 + 3 H2O + 3 NO2
- Bi(NO3)3 + 3 NaCl → BiCl3 + 3 NaNO3
化學性質
[編輯]- Bi3+
+ Cl−
+ H
2O → BiOCl (s) + 2 H+
故配製Bi³⁺離子的溶液需要加酸抑制其水解。[3]
氯化鉍是一種氧化劑,遇還原劑如氯化亞錫生成黑色的金屬鉍粉末,此反應可用於檢驗Bi³⁺。
氯配合物
[編輯]氯化鉍作為一種路易斯酸,在Cl-濃度高的溶液中能形成各種氯配合物,如BiCl63−。其八面體結構與價層電子對互斥理論的判斷不符, 不過BiCl52−的四方錐結構符合該理論的判斷。[4]
 |
 |
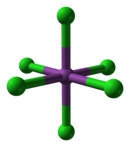 |
有機反應催化劑
[編輯]氯化鉍用於有機合成的催化劑,例如米高加成反應,碘的加入能提高催化效率。[5]
安全性
[編輯]氯化鉍有毒,能刺激胃腸道和呼吸道,與皮膚接觸可能導致灼傷。
參考資料
[編輯]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Joel Henry Hildebrand. Principles of Chemistry. BiblioBazaar, LLC. 2008: 191. ISBN 0-559-31877-4.
- ^ Frank Welcher. Chemical Solutions. READ BOOKS. 2008: 48. ISBN 1-4437-2907-8.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Hitomi Suzuki; Yoshihiro Matano. Organobismuth chemistry. Elsevier. 2001: 403–404. ISBN 0-444-20528-4.

