鄰二氮菲
外觀
| 鄰二氮菲 | |
|---|---|
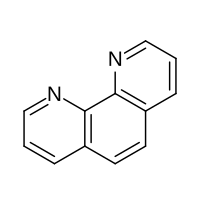
| |

| |
| IUPAC名 1,10-phenanthroline | |
| 別名 | 鄰菲羅啉、鄰菲囉啉、 鄰二氮雜菲、鄰菲咯啉、 1,10-菲囉啉 |
| 識別 | |
| CAS號 | 66-71-7(無水) 5144-89-8(一水) |
| ChemSpider | 1278 |
| SMILES |
|
| InChI |
|
| InChIKey | DGEZNRSVGBDHLK-UHFFFAOYAW |
| ChEBI | 44975 |
| RTECS | SF8300000 |
| DrugBank | DB02365 |
| 性質 | |
| 化學式 | C12H8N2 |
| 摩爾質量 | 180.3 g·mol⁻¹ |
| 外觀 | 無色晶體 |
| 熔點 | 117 °C |
| 溶解性(水) | 中度可溶 |
| 溶解性(其他溶劑) | 可溶於丙酮、乙醇、苯,不溶於石油醚 |
| 危險性 | |
| 警示術語 | R:R25, R50/53 |
| 安全術語 | S:S45,S60,S61 |
| 主要危害 | 具有中度的神經毒性,強腎毒性和利尿作用 |
| 相關物質 | |
| 相關化學品 | 2,2'-聯吡啶、菲、 鄰二氮菲亞鐵離子 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
鄰二氮菲,即「1,10-鄰二氮雜菲」,也稱鄰菲羅啉、鄰菲囉啉、鄰菲咯啉,是一種常用的氧化還原指示劑。它是一個雙齒雜環化合物配體,類似於2,2'-聯吡啶,會與大多數金屬離子形成很穩定的配合物。[1][2]
鄰二氮菲最常用的應用是分光光度法測定鐵。它可通過鄰苯二胺、硫酸、甘油和砷酸的水溶液回流反應製取。[3]
鄰二氮菲在pH為2~9時,會與亞鐵離子(Fe2+)形成穩定的橙紅色鄰二氮菲亞鐵離子([Fe(phen)3]2+),可通過分光光度法來分析。[4]logK=21.3,摩爾吸收係數為1.1×104,最大吸收峰在508nm。該法選擇性高。氧化型[Fe(phen)3]3+顯淺藍色,半反應為:
鄰二氮菲-Fe(II)指示劑可通過將1.485g一水合鄰二氮菲和0.695gFeSO4·7H2O溶於100mL水中來配製。用於硫酸鈰(Ⅳ)滴定鐵鹽的指示劑。一個相關的配體是紅菲繞啉(BPT),4,7-二苯基-1,10-鄰二氮菲。[1]
鄰二氮菲也可用於烷基鋰化合物含量的分析。具體步驟是使樣品與少量(約1mg)的鄰二氮菲作用,呈深色,再用醇類滴定,直到達到無色的滴定終點。[5]
參見
[編輯]參考資料
[編輯]- ^ George B. Kauffman, Lloyd T. Takahashi. Resolution of the tris-(1,10-Phenanthroline)Nickel(II) Ion. Inorg. Synth. 1966, 5: 227–232.
- ^ F. P. Dwyer, E. C. Gyarfas, W. P. Rogers, J. H. Koch. Biological Activity of Complex Ions. Nature. 1952, 170: 190–191. doi:10.1038/170190a0.
- ^ B. E. Halcrow, W. O. Kermack. 43. Attempts to find new antimalarials. Part XXIV. Derivatives of o-phenanthroline (7 : 8 : 3′ : 2′-pyridoquinoline). J. Chem. Soc. 1946: 155–157. doi:10.1039/jr9460000155.
- ^ Belcher, R. "Application of chelate Compounds in Analytical Chemistry" Pure and Applied Chemistry, 1973, volume 34, pages 13-27.
- ^ Paul J. Fagan and William A. Nugent (1998). "1-Phenyl-2,3,4,5-Tetramethylphosphole". Org. Synth.; Coll. Vol. 9: 653.
外部連結
[編輯]- 鄰二氮菲分光光度法測定鐵 (頁面存檔備份,存於互聯網檔案館)


![{\displaystyle [H^{+}]=1mol/L,E^{\ominus }=1.06V}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fa2e77b2f08b2f9d930e07486e96c1a6954db9b)