布魯克重排反應
布魯克重排反應早期是指鹼作用下矽基從碳原子向氧原子的陰離子型-遷移反應,目前已拓展至所有-碳向氧的矽基遷移反應,現在已發展至-遷移反應。反應是從羥基矽烷到矽醚的轉化。[1]

反應得名於加拿大化學家阿德里安·吉布斯·布魯克。
矽原子上的取代基可以是脂肪基團或芳香基團,醇可以是仲醇或叔醇;脂肪醇或芳香醇。常用的鹼有胺類、氫氧化鈉、有機鋰試劑或鹼金屬合金如鈉鉀合金。
布魯克重排反應的相反過程,矽基從氧到碳上的分子內遷移反應也可以發生,稱為逆布魯克重排反應。[2]
醯基矽烷[3]的布魯克重排,以及氮雜[4]和磷雜布魯克重排都有報道。
反應機理
[編輯]布魯克重排反應及逆布魯克重排反應均經過同樣的矽負離子中間體。
反應機理中,首先是鹼奪取羥基氫,生成烷氧負離子,然後烷氧負離子作為親核試劑進攻矽原子,經過環狀的矽負離子過渡態(對於 -遷移來說是三元環),負電荷轉移到碳原子上,Si-C 鍵斷裂生成碳負離子,最後碳負離子從質子供體奪取一個質子生成產物矽基醚。

由於反應中間體為有用的碳負離子,因此可發生進一步的串聯反應。[5] 這一策略作為高效的方法學,正在天然產物合成中獲得日漸廣泛的應用。
底物為(三苯矽基)甲基苯基原醇時,研究發現反應的活化能並不很高,但活化熵卻是十分小的負值,從而證實了反應中環狀過渡態的存在。另外,通過研究對位取代基不同的苯基原醇發生反應的哈米特方程結果,也可以證實吸電子基團對反應中碳負離子中間體的穩定作用。
布魯克重排反應的推動力是產物中鍵能較高的Si-O鍵的生成。
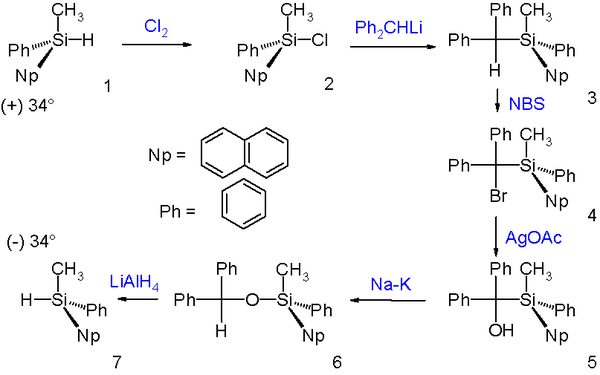
布魯克重排反應後得到構型保持的產物。下圖中的例子就利用了這個性質,使烴基取代矽烷的(+)-對映體在經過一系列反應後轉變為對應的(−)-異構體。首先它被氯氣氯化為氯矽烷,氯矽烷與二苯甲基鋰發生親核取代作用,伴隨構型翻轉。然後為了除去二苯甲基,作者首先用N-溴代丁二醯亞胺(NBS)將其溴化,接著用乙酸銀處理得到醇,然後使其在鈉鉀合金作用下發生布魯克重排反應,生成二苯甲氧基取代的衍生物,並用氫化鋁鋰將Si-O鍵切斷,最終得到需要的(−)-烴基矽烷異構體。
參考資料
[編輯]- ^ A. G. Brook. Molecular rearrangements of organosilicon compounds. Acc. Chem. Res. 1974, 7 (3): 77–84. doi:10.1021/ar50075a003.
- ^ William F. Bailey and Xinglong Jiang. Stereochemistry of the cyclization of 4-(t-butyldimethyl)siloxy-5-hexenyllithium: cis-selective ring-closure accompanied by retro-[1,4]-Brook rearrangement (PDF). Arkivoc. 2005: 25–32.[永久失效連結]
- ^ Patrocinio, Amauri F. and Moran, Paulo J. S. Acylsilanes and their applications in organic chemistry. J. Braz. Chem. Soc. 2001, 12 (1): 7–31 [2009-09-19]. (原始內容存檔於2007-09-29).. ISSN 0103-5053.
- ^ Philip C. Bulman Page, Monique B. van Niel and Donald Westwood. Reactions of metallated 1,3-dithianes with carboxylic acid derivatives. J. Chem. Soc., Perkin Trans. 1. 1988, (2): 269–275. doi:10.1039/P19880000269.
- ^ Amos B. Smith, III, Ming Xian, Won-Suk Kim and Dae-Shik Kim. The [1,5]-Brook Rearrangement: An Initial Application in Anion Relay Chemistry. J. Am. Chem. Soc. 2006, 128 (38): 12368–12369. doi:10.1021/ja065033e.

![{\displaystyle {\rm {\ [1,2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a172bf0bb88d7ef349b574a6b07d254a3bf3982)


![{\displaystyle {\rm {\ ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dcebe92c17c0607e733d94ac1d6e7da15af3a416)
![{\displaystyle {\rm {\ [1,5]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59a93ed7ab1146fd601d3743a07065cf02bc9375)