拜耳-維立格氧化反應
| 拜爾-維立格氧化重排反應 | |
|---|---|
| 命名根據 | Adolf von Baeyer Victor Villiger |
| 反應類型 | 有機氧化還原反應 |
| 標識 | |
| 有機化學網站對應網頁 | baeyer-villiger-oxidation |
| RSC序號 | RXNO:0000031 |
拜爾-維立格氧化重排反應(英語:Baeyer-Villiger oxidation)是酮在過氧化物(如過氧化氫、過氧乙酸等)的氧化下,於羰基和一個鄰近烴基之間插入一個氧原子,得到相應的酯的化學反應 [1]。醛可以進行同樣的反應,氧化的產物是相應的羧酸。


反應機理
[編輯]從表面上看來,該反應僅是一個氧原子對碳-碳鍵進行的插入反應。事實上,該反應是一個典型的1,2-遷移反應,其機制與霍夫曼重排、頻納醇重排等是類似的。

首先,反應物的羰基被質子化(1),從而易於接受過氧酸的親核進攻(2)。親核加成的產物中帶有一個氧鎓離子,其質子將較容易轉移到鄰近的氧原子上,形成克里格中間體(3)。隨後,與原來過氧酸對應的羧酸從中間體離去,留下一個缺電子的氧正離子(4)。由於氧具有很高的電負性,缺電子的氧是不穩定的,酮上的一個取代基(這裡是R2)協同地遷移到氧上形成酯(5),並很快脫去質子而得到最終產物(6)[1] 。(4)被認為是決速步[2]。
立體電子效應
[編輯]Baeyer-Villiger氧化反應的產物被認為是受立體電子效應控制的,該反應中的初級立體電子效應[註 1]指的是過氧化物中的O-O鍵必須在遷移基團RM的反面,這一取向有利於遷移軌道的𝛔軌道與過氧基𝛔*軌道的最大重疊[3]。次級立體電子效應[註 2]指的是羥基氧上的孤對電子必須在遷移基團RM的反面[1],這一取向有利於氧上非鍵軌道與遷移基團RM的𝛔*軌道的最大重疊[3]。反應中基團遷移的一步被認為(至少模擬分析如此)是由兩或三個過氧酸單元協助的,使質子能夠轉移到目標位置[4]。

基團遷移能力的順序為:叔烷基 > 環己基 > 仲烷基 > 芳基 > 伯烷基[5]。烯丙基發生遷移的能力介於伯烷基與仲烷基之間[6]。取代基上的吸電子基團會降低遷移率[7],對於遷移能力的這種趨勢有兩種解釋,第一種解釋認為是克里格中間體過渡態分解時正電荷的聚積[8],被取代的程度越大,碳正離子的穩定性就越強[9],因此有叔基 > 仲基 > 伯基的趨勢。

另一種解釋認為過渡態分子中的過氧基和非遷移取代基間存在鄰位交叉效應,如果較大的基團在過氧基的反面,則形成酯上的取代基和過氧酸的羰基間的鄰位交叉效應將減少。因此,大基團總是傾向於遷移到過氧基的反面[10]。

脂環酮中的遷移基團通常不會是伯烷基,不過,在使用CF3CO3H或BF3 + H2O2作為反應試劑的情況下,伯烷基可能會比仲、叔烷基更先發生遷移[11]。
歷史
[編輯]1899年,阿道夫·馮·拜耳和維克多·維立格首次發表了脂環酮,如薄荷酮、四氫香芹酮、樟腦與過一硫酸氧化形成內酯的研究報告[12][13],這一反應後來被命名為Baeyer-Villiger氧化反應[13][14]。
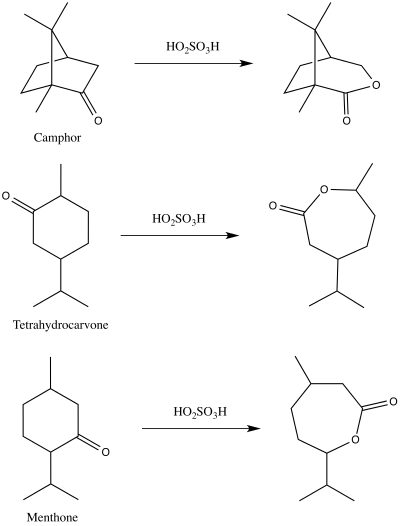
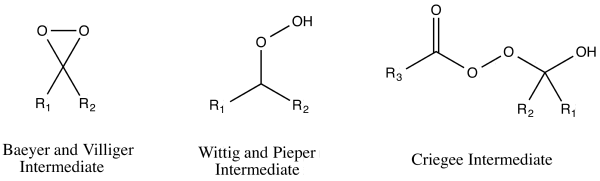
早期共提出了三種Baeyer-Villiger氧化反應的反應機理,在當時這三種機理都被認為是與相關動力學研究相符的[15]。這三種反應機理可被分為過氧酸進攻的兩條途徑:羰基氧或碳[16]。對氧進攻會得到兩種可能的中間體——由阿道夫·馮·拜耳和維克多·維立格提出的過氧化酮中間體,以及由格奧爾格·維蒂希和古斯塔夫·皮珀提出的過氧化物中間體[16]。對碳進攻則會得到由魯道夫·克里格提出的克里格中間體[16]。
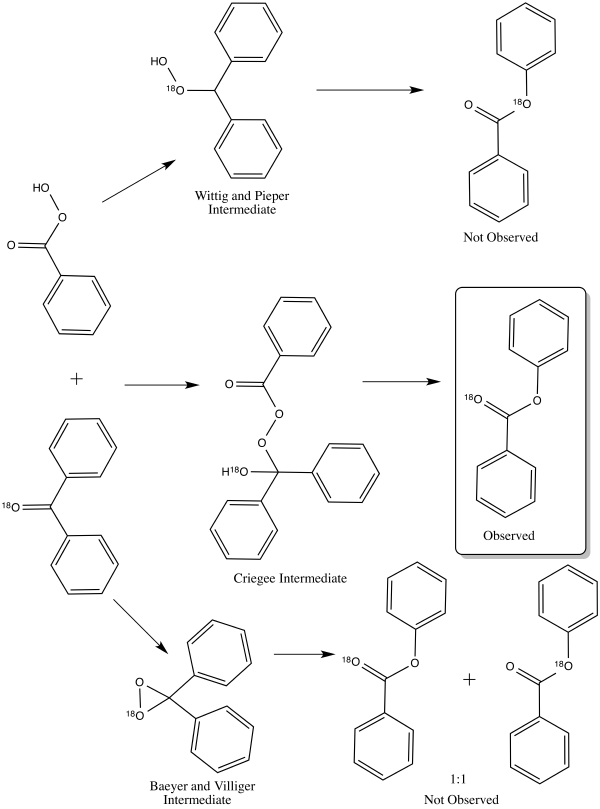
1953年,威廉·馮·艾格斯多林和埃德溫·多爾夫曼通過氧-18標記的二苯基甲酮進行Baeyer-Villiger氧化反應,闡明了該反應的機理[15]。三種不同的機理理論上分別會得到不同位置的同位素標記產物:克里格中間體的標記僅出現在羰基氧上、過氧化物中間體的標記僅出現在酯結構的烷氧基上、過氧化酮中間體的標記同時會出現在上述二者位置(產物比例為1:1)[15]。標記實驗的結果是只觀察到符合克里格中間體的產物,因此該路線也成為現今普遍認可的反應機理[1]。
立體化學
[編輯]取代基的遷移不會改變原本的立體結構,即是立體保持的[註 3][17][18]。
氧化劑
[編輯]常用於Baeyer-Villiger氧化反應的氧化劑有間氯過氧苯甲酸(mCPBA)和三氟過氧乙酸(TFPAA)[2]。總的趨勢是,氧化劑的對應羧酸(或過氧化物中對應的醇)的pKa越低,反應性越強[6]。常用的氧化劑反應性順序為[6]:
過氧化物的反應性遠低於過氧酸[2],過氧化氫作氧化劑時甚至需要使用催化劑 [5][19]。此外,使用有機過氧化物或過氧化氫時,也會產生更多的副反應[20]。
局限性
[編輯]由於反應中使用了過氧化物,因此會將不希望氧化的基團一併氧化。例如,底物中的烯烴(特別是富電子時)和胺,可能被氧化成環氧化合物[21]。不過,已經有研究提出了保護官能團的方法,例如1962年,G. B. Payne在硒催化劑存在時使用過氧化氫將烯基酮氧化成環氧結構,而使用過氧乙酸則得到了酯結構[22]。

改性
[編輯]催化Baeyer-Villiger氧化反應
[編輯]使用過氧化氫/催化劑的反應更加環保,反應的副產物僅為水[5]。據報道,使用苯亞硒酸衍生物作催化劑的反應表現出高選擇性[23]。固體路易斯酸催化劑,如錫矽分子篩[註 4]也表現出高選擇性[25],尤其是泡沸石Sn-β型和無定型Sn-MCM-41展現出完全選擇性[26][27]。
不對稱Baeyer-Villiger氧化反應
[編輯]有報道嘗試用有機金屬催化劑來進行對映選擇性的Baeyer-Villiger氧化反應[5],第一個報告前手性酮氧化的研究使用分子氧氧化,含銅催化劑催化,其他的如鉑、鋁催化劑也見報告。
Baeyer-Villiger單加氧酶
[編輯]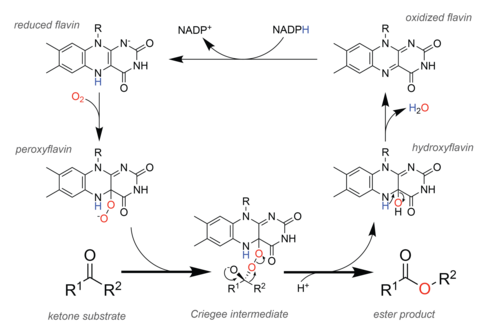
在自然界中,被稱為Baeyer-Villiger單加氧酶(BVMOs)的酶會進行類似化學反應的氧化過程[28]。為了促進該反應,BVMO含有一種黃素腺嘌呤二核苷酸(FAD)輔因子[29]。在催化循環中,細胞氧化還原當量的NADPH首先還原輔因子,使之隨後與分子氧反應。產生的過氧黃素是底物氧化反應的催化劑,理論分析表明,該反應通過克里格中間體進行[30]。重排後得到的羥基黃素會自發地脫水形成氧化黃素,完成催化循環。
BVMO與含黃素的單加氧酶(FMO)[31]密切相關,這些酶也存在於人體中,在肝臟的前線代謝解毒系統中沿細胞色素P450單加氧酶發揮作用[32]。人類FMO5被證明能夠催化Baeyer-Villiger反應,因此該反應也可能發生在人體內[33]。
BVMOs因其作為生物催化劑的潛力而被廣泛研究[34],酶在有機合成中通常是更環保的選擇[28]。BVMO更有趣的地方是,除了能應用在催化特定反應外,還發現它的一些天然同系物具有非常大的底物範圍[註 5](即反應性不限於單一的化合物)[35]。由於許多BVMO的三維結構已經確定,它們可以進行大規模生產,也可以應用酶工程生產具有改善熱穩定性、反應性的變種[36][37]。另一個優點是它們經常能觀察到區域/對映選擇性,這得益於酶的活性位點內的催化過程中底物方向的空間控制[28][34]。
應用
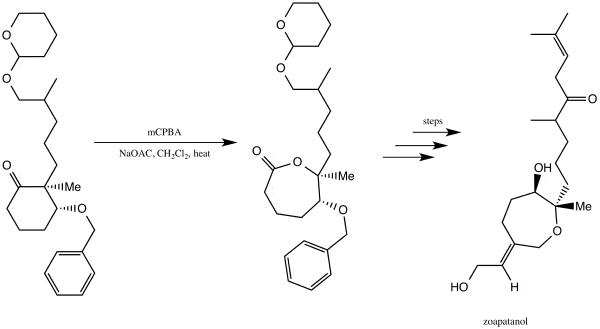
[編輯]Zoapatanol
[編輯]Zoapatanol是一種生物活性分子,天然存在於被稱作zeopatle的植物中,這種植物在墨西哥被用於製作誘導月經和分娩的茶[38]。1981年,Vinayak Kane與Donald Doyle報道了zoapatanol的全合成,他們使用Baeyer-Villiger氧化反應構建內酯,該步是合成zoapatanol的關鍵步[39][40]。
甾類
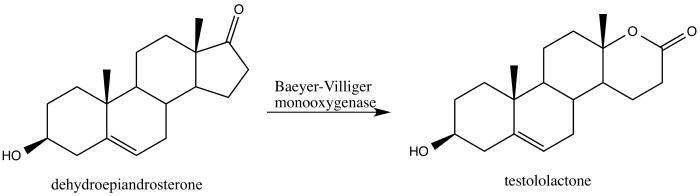
[編輯]2013年,Alina Świzdor報道了通過能產生BVMOs的真菌所誘導的Baeyer-Villiger氧化反應,該反應將脫氫表雄酮轉化為抗癌劑睪內酯酮[41]。
備註
[編輯]參見
[編輯]外部連結
[編輯]- 反應機理: gif動畫 (頁面存檔備份,存於網際網路檔案館)
參考文獻
[編輯]- ^ 1.0 1.1 1.2 1.3 Kürti, László; Czakó, Barbara. Strategic Applications of Named Reactions in Organic Synthesis
 . Burlington; San Diego; London: Elsevier Academic Press. 2005: 28. ISBN 978-0-12-369483-6.
. Burlington; San Diego; London: Elsevier Academic Press. 2005: 28. ISBN 978-0-12-369483-6.
- ^ 2.0 2.1 2.2 Krow, Grant R. The Baeyer-Villiger Oxidation of Ketones and Aldehydes. Organic Reactions. 1993, 43 (3): 251–798. ISBN 0471264180. doi:10.1002/0471264180.or043.03.
- ^ 3.0 3.1 Crudden, Cathleen M.; Chen, Austin C.; Calhoun, Larry A. A Demonstration of the Primary Stereoelectronic Effect in the Baeyer-Villiger Oxidation of α-Fluorocyclohexanones. Angew. Chem. Int. Ed. 2000, 39 (16): 2851–2855. doi:10.1002/1521-3773(20000818)39:16<2851::aid-anie2851>3.0.co;2-y.
- ^ Yamabe, Shinichi. The Role of Hydrogen Bonds in Baeyer−Villiger Reactions. The Journal of Organic Chemistry. 2007, 72 (8): 3031–3041. PMID 17367197. doi:10.1021/jo0626562.
- ^ 5.0 5.1 5.2 5.3 ten Brink, G.-J.; Arends, W. C. E.; Sheldon, R. A. The Baeyer-Villiger Reaction: New Developments toward Greener Procedures. Chem. Rev. 2004, 104 (9): 4105–4123. PMID 15352787. doi:10.1021/cr030011l.
- ^ 6.0 6.1 6.2 Myers, Andrew G. Chemistry 115 Handouts: Oxidation (PDF). [2022-07-09]. (原始內容存檔 (PDF)於2017-05-16).
- ^ Li, Jie Jack; Corey, E. J. (編). Name Reactions of Functional Group Transformations. Hoboken, NJ: Wiley-Interscience. 2007.
- ^ Hawthorne, M. Frederick; Emmons, William D.; McCallum, K. S. A Re-examination of the Peroxyacid Cleavage of Ketones. I. Relative Migratory Aptitudes. J. Am. Chem. Soc. 1958, 80 (23): 6393–6398. doi:10.1021/ja01556a057.
- ^ Jones, Jr., Maitland; Fleming, Steven A. Organic Chemistry
 4th. Canada: W. W. Norton & Company. 2010: 293. ISBN 978-0-393-93149-5.
4th. Canada: W. W. Norton & Company. 2010: 293. ISBN 978-0-393-93149-5.
- ^ Evans, D. A. Stereoelectronic Effects-2. Chemistry 206 (Fall 2006-2007).
- ^ Sanyal, S.N. Reactions, Rearrangements and Reagents 4. 2003: 90. ISBN 978-81-7709-605-7.
- ^ Baeyer, Adolf; Villiger, Victor. Einwirkung des Caro'schen Reagens auf Ketone. Ber. Dtsch. Chem. Ges. 1899, 32 (3): 3625–3633 [2022-07-09]. doi:10.1002/cber.189903203151. (原始內容存檔於2022-07-11).
- ^ 13.0 13.1 Hassall, C. H. The Baeyer-Villiger Oxidation of Aldehydes and Ketones. Organic Reactions. 1957, 9 (3): 73–106. ISBN 0471264180. doi:10.1002/0471264180.or009.03.
- ^ Renz, Michael; Meunier, Bernard. 100 Years of Baeyer-Villiger Oxidations. Eur. J. Org. Chem. 1999, 1999 (4): 737–750. doi:10.1002/(SICI)1099-0690(199904)1999:4<737::AID-EJOC737>3.0.CO;2-B.
- ^ 15.0 15.1 15.2 Doering, W. von E.; Dorfman, Edwin. Mechanism of the Peracid Ketone-Ester Conversion. Analysis of Organic Compounds for Oxygen-18. J. Am. Chem. Soc. 1953, 75 (22): 5595–5598. doi:10.1021/ja01118a035.
- ^ 16.0 16.1 16.2 Doering, W. von E.; Speers, Louise. The Peracetic Acid Cleavage of Unsymmetrical Ketones. Journal of the American Chemical Society. 1950, 72 (12): 5515–5518. doi:10.1021/ja01168a041.
- ^ Turner, Richard B. Stereochemistry of the Peracid Oxidation of Ketones. J. Am. Chem. Soc. 1950, 72 (2): 878–882. doi:10.1021/ja01158a061.
- ^ Gallagher, T. F.; Kritchevsky, Theodore H. Perbenzoic Acid Oxidation of 20-Ketosteroids and the Stereochemistry of C-17. J. Am. Chem. Soc. 1950, 72 (2): 882–885. doi:10.1021/ja01158a062.
- ^ Cavarzan, Alessandra; Scarso, Alessandro; Sgarbossa, Paolo; Michelin, Rino A.; Strukul, Giorgio. Green Catalytic Baeyer–Villiger Oxidation with Hydrogen Peroxide in Water Mediated by Pt(II) Catalysts. ChemCatChem. 2010, 2 (10): 1296–1302. S2CID 98508888. doi:10.1002/cctc.201000088.
- ^ Schweitzer-Chaput, Bertrand; Kurtén, Theo; Klussmann, Martin. Acid-Mediated Formation of Radicals or Baeyer-Villiger Oxidation from Criegee Adducts. Angewandte Chemie International Edition. 2015, 54 (40): 11848–11851. PMID 26267787. doi:10.1002/anie.201505648.
- ^ Grant R. Krow. Trost, Barry M.; Fleming, Ian , 編. Comprehensive Organic Synthesis - Selectivity, Strategy and Efficiency in Modern Organic Chemistry, Volumes 1 - 9. Elsevier. 1991: 671–688 [2022-07-09]. ISBN 978-0-08-035930-4. (原始內容存檔於2022-07-08).
- ^ Payne, G. B. A Simplified Procedure for Epoxidation by Benzonitrile-Hydrogen Peroxide. Selective Oxidation of 2-Allylcyclohexanone. Tetrahedron. 1962, 18 (6): 763–765. doi:10.1016/S0040-4020(01)92726-7.
- ^ ten Brink, Gerd-Jan; Vis, Jan-Martijn; Arends, Isabel W. C. E.; Sheldon, Roger A. Selenium-Catalyzed Oxidations with Aqueous Hydrogen Peroxide. 2. Baeyer−Villiger Reactions in Homogeneous Solution. J. Org. Chem. 2001, 66 (7): 2429–2433. PMID 11281784. doi:10.1021/jo0057710.
- ^ LIU Yujia; XIA Changjiu; LIN Min; ZHU Bin; PENG Xinxin; LUO Yibin; SHU Xingtian. Stannosilicate molecular sieve: a new star in heteroatom incorporated zeolite family 39 (2): 605–615. 2020.
- ^ Ferrini, Paola; Dijkmans, Jan; Clercq, Rik De; Vyver, Stijn Van de; Dusselier, Michiel; Jacobs, Pierre A.; Sels, Bert F. Lewis acid catalysis on single site Sn centers incorporated into silica hosts. Coordination Chemistry Reviews. 2017, 343: 220–255. doi:10.1016/j.ccr.2017.05.010.
- ^ Corma, A; Navarro, MT; Nemeth, L; Renz, M. Sn-MCM-41—a heterogeneous selective catalyst for the Baeyer-Villiger oxidation with hydrogen peroxide. Chemical Communications. 7 November 2001, (21): 2190–1. ISSN 1364-548X. PMID 12240094. doi:10.1039/B105927K.
- ^ Renz, M; Blasco, T; Corma, A; Fornés, V; Jensen, R; Nemeth, L. Selective and shape-selective Baeyer-Villiger oxidations of aromatic aldehydes and cyclic ketones with Sn-beta zeolites and H2O2. Chemistry. 18 October 2002, 8 (20): 4708–17. ISSN 1521-3765. PMID 12561111. doi:10.1002/1521-3765(20021018)8:20<4708::AID-CHEM4708>3.0.CO;2-U.
- ^ 28.0 28.1 28.2 Leisch, Hannes; Morley, Krista; Lau, Peter C. K. Baeyer−Villiger Monooxygenases: More Than Just Green Chemistry. Chemical Reviews. 13 July 2011, 111 (7): 4165–4222 [2022-07-09]. ISSN 0009-2665. PMID 21542563. doi:10.1021/cr1003437. (原始內容存檔於2021-09-26).
- ^ Sheng, Dawei; Ballou, David P.; Massey, Vincent. Mechanistic Studies of Cyclohexanone Monooxygenase: Chemical Properties of Intermediates Involved in Catalysis. Biochemistry. 1 September 2001, 40 (37): 11156–11167. ISSN 0006-2960. PMID 11551214. doi:10.1021/bi011153h.
- ^ Polyak, Iakov; Reetz, Manfred T.; Thiel, Walter. Quantum Mechanical/Molecular Mechanical Study on the Mechanism of the Enzymatic Baeyer–Villiger Reaction. Journal of the American Chemical Society. 8 February 2012, 134 (5): 2732–2741. ISSN 0002-7863. PMID 22239272. doi:10.1021/ja2103839.
- ^ van Berkel, W. J. H.; Kamerbeek, N. M.; Fraaije, M. W. Flavoprotein monooxygenases, a diverse class of oxidative biocatalysts. Journal of Biotechnology. 5 August 2006, 124 (4): 670–689. ISSN 0168-1656. PMID 16712999. doi:10.1016/j.jbiotec.2006.03.044. hdl:11370/99a1ac5c-d4a4-4612-90a3-4fe1d4d03a11
 (英語).
(英語).
- ^ Iyanagi, Takashi. Molecular Mechanism of Phase I and Phase II Drug‐Metabolizing Enzymes: Implications for Detoxification. International Review of Cytology (Academic Press). 1 January 2007, 260: 35–112 [2022-07-09]. ISBN 9780123741141. PMID 17482904. doi:10.1016/S0074-7696(06)60002-8. (原始內容存檔於2022-07-12) (英語).
- ^ Fiorentini, Filippo; Geier, Martina; Binda, Claudia; Winkler, Margit; Faber, Kurt; Hall, Mélanie; Mattevi, Andrea. Biocatalytic Characterization of Human FMO5: Unearthing Baeyer–Villiger Reactions in Humans. ACS Chemical Biology. 15 April 2016, 11 (4): 1039–1048. ISSN 1554-8929. PMID 26771671. doi:10.1021/acschembio.5b01016.
- ^ 34.0 34.1 Fürst, Maximilian J. L. J.; Gran-Scheuch, Alejandro; Aalbers, Friso S.; Fraaije, Marco W. Baeyer–Villiger Monooxygenases: Tunable Oxidative Biocatalysts. ACS Catalysis. 6 December 2019, 9 (12): 11207–11241. doi:10.1021/acscatal.9b03396
 .
.
- ^ Fürst, Maximilian J. L. J.; Romero, Elvira; Gómez Castellanos, J. Rúben; Fraaije, Marco W.; Mattevi, Andrea. Side-Chain Pruning Has Limited Impact on Substrate Preference in a Promiscuous Enzyme. ACS Catalysis. 7 December 2018, 8 (12): 11648–11656. PMC 6345240
 . PMID 30687578. doi:10.1021/acscatal.8b03793
. PMID 30687578. doi:10.1021/acscatal.8b03793  .
.
- ^ Fürst, Maximilian J. L. J.; Boonstra, Marjon; Bandstra, Selle; Fraaije, Marco W. Stabilization of cyclohexanone monooxygenase by computational and experimental library design. Biotechnology and Bioengineering. 2019, 116 (9): 2167–2177. ISSN 1097-0290. PMC 6836875
 . PMID 31124128. doi:10.1002/bit.27022
. PMID 31124128. doi:10.1002/bit.27022  (英語).
(英語).
- ^ Li, Guangyue; Garcia-Borràs, Marc; Fürst, Maximilian J. L. J.; Ilie, Adriana; Fraaije, Marco W.; Houk, K. N.; Reetz, Manfred T. Overriding Traditional Electronic Effects in Biocatalytic Baeyer–Villiger Reactions by Directed Evolution. Journal of the American Chemical Society. 22 August 2018, 140 (33): 10464–10472. ISSN 0002-7863. PMC 6314816
 . PMID 30044629. doi:10.1021/jacs.8b04742.
. PMID 30044629. doi:10.1021/jacs.8b04742.
- ^ Levine, Seymour D.; Adams, Richard E.; Chen, Robert; Cotter, Mary Lou; Hirsch, Allen F.; Kane, Vinayak V.; Kanojia, Ramesh M.; Shaw, Charles; Wachter, Michael P.; Chin, Eva; Huettemann, Richard; Ostrowski, Paul. Zoapatanol and Montanol, Novel Oxepane Diterpenoids, from the Mexican Plant Zoapatle (Montanoa tomentosa). J. Am. Chem. Soc. 1979, 101 (12): 3405–3407. doi:10.1021/ja00506a057.
- ^ Kane, Vinayak V.; Doyle, Donald L. Total Synthesis of (±) Zoapatanol: A Stereospecific Synthesis of a Key Intermediate. Tetrahedron Lett. 1981, 22 (32): 3027–3030. doi:10.1016/S0040-4039(01)81818-9.
- ^ Kane, Vinayak V.; Doyle, Donald L. Total Synthesis of (±) Zoapatanol. Tetrahedron Lett. 1981, 22 (32): 3031–3034. doi:10.1016/S0040-4039(01)81819-0.
- ^ Świzdor, Alina. Baeyer-Villiger Oxidation of Some C19 Steroids by Penicillium lanosocoeruleum. Molecules. 2013, 18 (11): 13812–13822. PMC 6270215
 . PMID 24213656. doi:10.3390/molecules181113812
. PMID 24213656. doi:10.3390/molecules181113812  .
.
