新煙裂鹼
| 新煙裂鹼 | |
|---|---|

| |
| IUPAC名 3,4,5,6-四氫-2,3′-聯吡啶 3,4,5,6-Tetrahydro-2,3′-bipyridine | |
| 別名 | 假木賊因 |
| 識別 | |
| CAS號 | 3471-05-4 |
| PubChem | 18985 |
| ChemSpider | 17923 |
| SMILES |
|
| ChEBI | 80787 |
| KEGG | C06522 |
| IUPHAR配體 | 347 |
| 性質 | |
| 化學式 | C10H12N2 |
| 摩爾質量 | 160.22 g·mol−1 |
| 外觀 | 油狀液體 |
| 氣味 | 無 |
| 沸點 | 110-120°C |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
新煙裂鹼[1](英語:Anabaseine)又稱假木賊因[2],學名3,4,5,6-四氫-2,3′-聯吡啶。其為一種從海洋紐蟲和長腳家蟻產生的有毒生物鹼[3]。
在結構上與尼古丁和假木賊鹼相似,對中樞和外周神經系統中大多數菸鹼型乙醯膽鹼受體可同樣起到激動劑作用[4]。
作用機制和效果
[編輯]新煙裂鹼的亞胺離子形式可以和上述提到的大多數菸鹼型乙醯膽鹼受體結合,但其對於大腦的α7亞基受體和骨骼肌受體結合能力更強[5],導致神經細胞去極化,並誘導同時釋放多巴胺和去甲腎上腺素[4]。
新煙裂鹼會使甲殼動物和昆蟲癱瘓,但對脊椎動物無癱瘓作用,推測其作為外周神經菸鹼型乙醯膽鹼受體激動劑所導致[4]。
結構
[編輯]新煙裂鹼結構中含有一個無芳香性的四氫吡啶環以及一個吡啶環,之間通過相互連接形成一個2,3′-聯吡啶結構。在不同的pH的生理環境中有三種形式:酮式(ketone)、亞胺離子式(iminium)以及亞胺式(imine)結構[4]。由於結構中的亞胺直接與吡啶環相連形成共軛結構,使得新煙裂鹼為一個近平面分子。

合成
[編輯]新煙裂鹼由Spath和Mamoli於1936年首次合成得到[6]。採用2-哌啶酮和苯甲酸酐反應生成N-苯甲醯哌啶酮,隨後將其與煙酸乙酯(NaOEt)反應得到α-煙醯基-N-苯甲醯-2-哌啶酮。隨後經過脫羧,環化以及醯胺水解就得到新煙裂鹼。
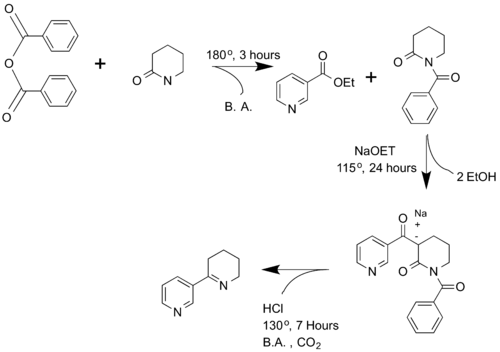
後續也有研究者發明了其他合成新煙裂鹼的方法[7][8][9][10]。
衍生物
[編輯]由於新煙裂鹼與菸鹼型乙醯膽鹼受體結合幾乎沒有特異性,使得新煙裂鹼在很大程度上被視為研究或醫學中的有用工具。但對新煙裂鹼分子進行修飾,可以得到α7受體特異性結合的衍生藥物。如一種處於開發階段的藥物GTS-21(3-(2,4-二甲氧基苯亞甲基)新煙裂鹼)被研究用於治療與精神分裂症相關的記憶缺陷疾病[11]。此外,對新煙裂鹼中吡啶環進行修飾可得到對α3β4菸鹼乙醯膽鹼受體功能選擇性結合的藥物[12]。
參考文獻
[編輯]- ^ 崔清晨,孫秉一,顧宏堪,馬希年. 海洋化学辞典. 北京: 海洋出版社. 1993. ISBN 9787502700850.
- ^ 蘇子仁,賴小平 (編). 汉英、英汉中草药化学成分词汇. 北京: 中國中醫藥出版社. 2006. ISBN 9787801569103.
- ^ Wheeler, JW; Olubajo, O; Storm, CB; Duffield, RM. Anabaseine: venom alkaloid of aphaenogaster ants.. Science. 6 March 1981, 211 (4486): 1051–2. Bibcode:1981Sci...211.1051W. PMID 17744933. doi:10.1126/science.211.4486.1051.
- ^ 4.0 4.1 4.2 4.3 Kem, William; Soti, Ferenc; Wildeboer, Kristin; LeFrancois, Susan; MacDougall, Kelly; Wei, Dong-Qing; Chou, Kuo-Chen; Arias, Hugo R. The Nemertine Toxin Anabaseine and Its Derivative DMXBA (GTS-21): Chemical and Pharmacological Properties. Marine Drugs. 2006-04-06, 4 (3): 255–273. PMC 3663414
 . doi:10.3390/md403255
. doi:10.3390/md403255  .
.
- ^ Kem, WR; Mahnir, VM; Papke, RL; Lingle, CJ. Anabaseine is a potent agonist on muscle and neuronal alpha-bungarotoxin-sensitive nicotinic receptors.. The Journal of Pharmacology and Experimental Therapeutics. December 1997, 283 (3): 979–92. PMID 9399967.
- ^ Padilla, Edited by Dean F. Martin [and] George M. Marine pharmacognosy; action of marine biotoxins at the cellular level.
 First. New York: Academic Press. 1973: 54–55. ISBN 978-0124745506.
First. New York: Academic Press. 1973: 54–55. ISBN 978-0124745506.
- ^ Bloom, Linda. Influence of solvent on the ring-chain hydrolysis equilibrium of anabaseine and synthesis of anabaseine and nicotine analogues.. University of Florida. [5 May 2015]. (原始內容存檔於2024-07-29).
- ^ Zoltewicz, John A.; Cruskie, Michael P. A Superior Synthesis of Cholinergic Anabaseine. Organic Preparations and Procedures International. August 1995, 27 (4): 510–513. doi:10.1080/00304949509458490.
- ^ Smith, Aaron. Synthesis and Radiolabeling of Potassium Trifluoroborate Benzilidene Anabaseine Derivatives. University of Tennessee - Knoxville.
- ^ Villemin, Didier; Hachemi, Messaoud. Cesium Fluoride on Calcium Oxide as a Strongly Basic Catalyst. Synthesis of Flavones and Tobacco Alkaloids. Reaction Kinetics and Catalysis Letters. 2001, 72 (1): 3–10. S2CID 92416597. doi:10.1023/A:1010597826749.
- ^ Celanire, Sylvain; Poli, Sonia. Small Molecule Therapeutics for Schizophrenia. Springer. 2014-10-13: 248 [2015-04-20]. ISBN 9783319115023.
- ^ Matera, Carlo; Quadri, Marta; Sciaccaluga, Miriam; Pomè, Diego Yuri; Fasoli, Francesca; De Amici, Marco; Fucile, Sergio; Gotti, Cecilia; Dallanoce, Clelia. Modification of the anabaseine pyridine nucleus allows achieving binding and functional selectivity for the α3β4 nicotinic acetylcholine receptor subtype. European Journal of Medicinal Chemistry. 2016-01-27, 108: 392–405. PMID 26706350. doi:10.1016/j.ejmech.2015.11.045. hdl:2434/352478
 .
.
