環己烷構象

環己烷構象主要研究環己烷及其相關衍生物的構象,是構象分析的重要內容。
歷史背景
[編輯]很早就有人提出環己烷可能不是平面型結構。1890年,德國人赫爾曼·薩克森(Hermann Sachse)提出通過摺紙來構建環己烷「對稱」和「非對稱」結構(即現椅型和船型結構)的方法,從他的文章可以感受出,他已經知曉這些構象有兩種不同的氫原子(即現直鍵氫和平鍵氫)以及兩種椅型結構可能會相互轉化,甚至還意識到兩種椅型結構的分布可能受環上某些取代基的影響。不過他的文章沒有獲得化學家的足夠重視,一方面是文章的數學成分太多,難以理解,另一方面則是他的文章沒有發表到主要的期刊上。1893年僅31歲的薩克森去世,他的研究也就此結束。直到1918年恩斯特·莫耳(Ernst Mohr)用新問世的X射線晶體學技術測定金剛石結構時,才發現所得結構中的基礎結構單元正是薩克森預測過的椅型結構,才使環己烷構象研究重新進入焦點之中。[1][2][3]
椅型構象
[編輯]sp3混成的碳原子是四價的,鍵間角度為109.5°,所以環己烷不是平面的鍵角120°的正六邊形結構,而是採取多種三維的構象。椅型構象描述的是普通狀態環己烷最穩定的構象,25度時99.99%的環己烷分子都是這種構象。德里克·巴頓和奧德·哈塞爾因對環己烷和其他分子構象的研究而獲得諾貝爾化學獎。
能量最低的椅型構象中,12個氫原子中有6個處於豎直方向(紅色)——這些碳-氫鍵互相平行,呈軸向排列,分列環上下,稱為直鍵。另6個氫處於近似水平方向(藍色)——這些碳-氫鍵大致平伏,分別稍向下和向上翹起,稱為平鍵。對於同一碳原子來說,若與它相連的直鍵氫是向上的,則平鍵氫稍向下,反之亦然。
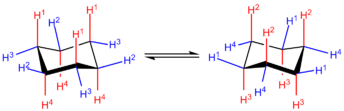
觀察可知,對於連有向上直鍵、稍向下平鍵的碳原子,與其相鄰的兩個碳原子必然連有向下直鍵和稍向上平鍵。而且環中相對碳原子所連平鍵和直鍵的方向也必然是分別相反的(如H1和H4)。所以對於反式的鄰二取代環己烷,兩個取代基只會同時為平鍵或同時為直鍵,總之分處環兩邊。同樣對於順式的鄰二取代環己烷,兩個取代基必定是一個為平鍵,一個為直鍵,而且指向同一個方向。其他取代的環己烷衍生物也可以依這樣推理。
椅型構象中2、4、6號碳同處一個平面,1、3、5號碳同處一個平面。位於上面的平面的碳連有向上的直鍵、稍向下的平鍵,位於下層平面的碳連有向下的直鍵和稍向上的平鍵。椅型中所有鍵角都近似正四面體鍵角,而且所有相鄰碳上的氫都處於鄰位交叉,沒有扭轉張力。
上面畫出了環己烷的兩個不同排列的椅型構象,對於未取代的環己烷而言,這兩個構象是完全相同的,不過當環上有取代基時兩個構象常是不同的,這可以通過構建分子模型來證實。兩個椅型構象間的轉化稱為環翻轉,該過程中所有直鍵氫變為平鍵氫,平鍵氫變為直鍵氫。最左邊的碳原子在翻轉後仍然處於最左邊,只不過從上層平面變到下層平面(或相反),所以相連的平鍵、直鍵也相應發生變化,最右邊的碳原子亦然。
兩個椅型構象可能因存在取代基而能量不同。一般來說取代基儘量取平鍵,以避免位阻效應。對於有順式1,3-雙取代的分子,兩取代基還要避免1,3-雙直鍵立體作用。以甲基環己烷為例,它主要採取平鍵甲基的椅型構象,主要原因不是甲基處直鍵時與其他直鍵氫間的1,3-雙直鍵作用,而是因為直鍵甲基會造成它與相隔的碳-碳鍵形成能量上不利的旁式構象(C1-CH3、C2-C3、C5-C6),即互成鄰位交叉。不過1,3-雙直鍵作用在1,3-順式雙取代分子中是顯著的,例如在分析順-1,3-二甲基環己烷時就要考慮到這一因素。
需要注意的是並不是所有情況下都是平鍵能量更低,涉及電負度雜原子的端基異構效應(Anomeric Effect)就是著名的例外,例如除葡萄糖外的所有L-己醛糖都受此效應影響,半縮醛羥基取直鍵而非平鍵在能量上更穩定。
取代基對平鍵的偏重可以用A值來衡量,即其平鍵和直鍵構象異構物間的吉布斯自由能差。正的A值表示偏好平鍵。A值範圍一般在0(氘等體積較小的取代基)到5 kcal/mol(如三級丁基等大取代基)之間。
船型構象
[編輯]除D3d對稱性的椅型構象(1)外環己烷還有半椅型/信封型(2)、扭船型(3/5,D2對稱性)和船型(4)等構象,但只有這之中扭船型可以和椅型一樣分離出來(因它為能量低點)。船型結構無角張力,但有兩個軸向1,4-氫間的空間張力(即所謂旗杆氫作用),而且因兩根碳-碳鍵處於重疊構象,所以也有扭轉張力,不如椅型構象穩定。船型結構可以折成其他構象以減少張力,如比它更加穩定的扭船型。
船型和半椅型構象分別是扭船型間和扭船-船型間的過渡態,無法分離出來。相對椅型,扭船型、船型和半椅型的能量分別為23、28、45 kJ/mol。[4]環翻轉實際上就是經過兩個半椅型、兩個扭船型和一船型構象,從一椅型翻到另一椅型的過程。
椅型和扭船型間的能差可通過對正逆轉化反應的活化能求差而間接求得。室溫下只有很少(<0.1%)的環己烷是以扭船型存在的,但在800度時該比例可以增至30%。可藉此對正反應(椅->扭船)進行研究。同樣將1073K的環己烷迅速冷卻到40K,用紅外光譜研究,就可以得到相應的逆反應數據。
[6.6]手性烷(Chiralane[5] [6])(T點群)是僅由相同扭船型環己烷稠合而成的分子的例子。扭曲烷是另一被迫含有扭船型的分子。
環己烷衍生物
[編輯]取代環己烷多有順反異構物,兩者無法通過類似線型分子中的簡單單鍵旋轉相互轉化。順式異構物(Z)中所指取代基指向同一方向(如同為向上直鍵/稍向上平鍵),而反式(E)則相反。雖然環己烷中的碳是由單鍵連接的,但環的剛性意味著順反間相互轉化只有在環系斷裂時才可以發生。
二取代環己烷中構象的能量受兩個取代基的相對排列方式影響。順-1,2-或-1,4-二取代環己烷中的取代基分處直鍵和平鍵,環翻轉後仍然是一平鍵一直鍵,至於哪種椅型更加穩定可以用取代基的A值進行預測。而反-1,2/1,4-二取代環己烷中的取代基必然同為直鍵或同為平鍵,但雙直鍵的構象因多含四個旁式構象而能量較高。類似對於1,3-二取代環己烷,順式主要是雙平鍵的構象,環翻轉後得到的雙直鍵構象立體張力太大。反-1,3-二取代環己烷類似順-1,2/1,4-,可在兩個近似的直鍵-平鍵椅型間翻轉。
對某些環己烷衍生物來說扭船型可能是更穩定的。如缺乏1,3-雙直鍵作用的1,2,4,5-四噻己環(用-S-替換環己烷的4個對稱-CH2-)的3,3,6,6-四甲基衍生物。1,4-環己二酮中穩定的構象也是扭船型,由於分子中無1,4-氫間作用。
順-1,4-二三級丁基環己烷若為船型則有一個三級丁基要處於直鍵。而在扭船型中兩個體積較大的三級丁基都可放在平鍵,所以扭船是比椅型更穩定的構象(125K時核磁共振譜測得能差1.96kJ/mol)。
參考資料
[編輯]- ^ H. Sachse, Chem. Ber, 1890, 23, 1363; Z. Physik. Chem, 1892, 10, 203; Z. Physik. Chem., 1893, 11, 185-219.
- ^ E. Mohr, J. Prakt. Chem., 1918, 98, 315 and Chem. Ber., 1922, 55, 230.
- ^ This history is nicely summarised here 網際網路檔案館的存檔,存檔日期2010-07-07..
- ^ Conformational Study of cis-1,4-Di-tert-butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations Gill, G.; Pawar, D. M.; Noe, E. A J. Org. Chem. (Article); 2005; 70(26); 10726-10731. DOI: 10.1021/jo051654z Abstract (頁面存檔備份,存於網際網路檔案館)
- ^ http://www.mazepath.com/uncleal/chiral2.gif (頁面存檔備份,存於網際網路檔案館) Chiralane
- ^ 存档副本. [2010-08-02]. (原始內容存檔於2009-09-07).
外部連結
[編輯]- Java applets of all conformations (頁面存檔備份,存於網際網路檔案館) from the University of Nijmegen
- Ring Conformations & Sterioisomers Detailed description of ring conformations and sterioisomers from Michigan State University


