威悌反應
| 威悌反應 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 命名根據 | 格奧爾格·威悌 | ||||||||||
| 反應類型 | 碳-碳鍵形成反應 | ||||||||||
| 反應 | |||||||||||
| |||||||||||
| 反應條件 | |||||||||||
| 常用溶劑 | 通常用四氫呋喃或乙醚 | ||||||||||
| 標識 | |||||||||||
| 馬奇《高等有機化學》章節 | 16–44(第6版) | ||||||||||
| 有機化學網站對應網頁 | wittig-reaction | ||||||||||
| RSC序號 | RXNO:0000015 | ||||||||||
| | |||||||||||
威悌反應(英語:Wittig reaction)是醛或酮與三苯基磷偶極體(威悌試劑)作用生成烯烴和三苯基氧膦的一類有機化學反應,以發明人德國化學家格奧爾格·威悌的姓氏命名。[1][2]
格奧爾格·威悌在1954年發現該反應,並因此獲得1979年諾貝爾化學獎。[3][4][5] 威悌反應在烯烴合成中有十分重要的地位。
威悌反應的反應物一般是醛/酮和單取代的磷偶極體。使用活潑葉立德時所得產物一般都是Z型的,或Z/E異構物比例相當;而使用比較穩定的葉立德時,或在Schlosser改進的條件下,產物則以E型為主。
反應機理
[編輯]經典機理
[編輯]威悌反應的經典機理為:

磷葉立德1中的電負度碳進攻與醛酮羰基2中的碳原子,發生親核加成。由於位阻原因,主要生成Ph3P+-和-O−處於反式的產物3。3C-C鍵旋轉得到偶極中間體4。4在-78°C時比較穩定。然後生成含氧四元環過渡態5。5發生消除得到順式烯烴7和三苯基氧膦6。
對於活潑的威悌試劑而言,與醛和酮反應時第一步的速率都較快,但第三步成環反應速率較慢,是速控步。但對於穩定的葉立德而言,R1基團可以穩定碳上的負電荷,第一步是速控步。因此總體的成烯反應速率減小,而且生成的烯烴中E型比例較大。這也是不活潑的威悌試劑與有位阻的酮反應很慢的緣故。
近期研究
[編輯]最近的研究表明,以上的機理並不能解釋所有的實驗數據。目前主要用核磁共振譜來研究活潑威悌試劑的反應中間體。但是對於偶極中間體(3a和3b)是否存在及它們之間的相互轉換,現在仍有爭議。[6] 有證據顯示磷葉立德1可以與羰基化合物2發生π²s/π²a [2+2]環加成反應,直接生成含氧的四元環4a和4b,並且產物5的立體化學與葉立德1和2羰基的加成以及4a和4b中間體之間的平衡有關。[7][8][9]布魯斯·瑪麗安諾夫(Bruce Maryanoff)和Reitz研究了它們之間的平衡,將其稱為「立體化學移動」(Stereochemical drift)。
多年以來,威悌反應的立體選擇性一直被認為與產物烯烴的Z/E標記有關,然而有一些反應物卻不遵守這樣簡單的規律。而且鋰鹽對反應的立體化學似乎也有複雜的影響。[10]

脂肪醛和芳香醛,以及脂肪族和芳香族的鏻鹽在發生威悌反應時也有顯著的不同。Vedejs等人已經表明直鏈醛在無鋰鹽存在時沒有可逆反應,整個反應是動力學控制的。[11][12] Vedejs也因此提出一套理論來解釋活潑和穩定威悌反應之間的差別。[13]
威悌試劑
[編輯]簡單威悌試劑的製備
[編輯]威悌試劑(Wittig)通常以四級鏻鹽在強鹼作用下失去一分子鹵化氫製備,而鏻鹽則可由三苯基膦和鹵代烴反應得到。前者製備反應通常在乙醚或四氫呋喃中進行,強鹼選用苯基鋰或正丁基鋰。
最簡單的威悌試劑是亞甲基三苯基膦(Ph3P+−C−H2),是一個橙黃色固體,對空氣和水都不穩定,可通過三苯基膦和溴甲烷生成的溴化三苯基甲基鏻 Ph3P+-CH3·Br− 在乾燥乙醚和氮氣流下用苯基鋰處理失溴化氫製得:[14]
- Ph3P + CH3Br → Ph3P+-CH3·Br− -(乾燥乙醚,PhLi)→ Ph3P+-CH2−
它也是另一種合成威悌試劑方法的原料。合成時一般不將它分離出來,而直接進行下一步的反應。
至於取代葉立德,可先用鹵代烴R−CH2−X烷基化Ph3P=CH2,得到一個取代的鏻鹽:
- Ph3P=CH2 + R-CH2-X → Ph3P+−CH2− CH2−R X−
再用C4H9Li脫去質子,生成Ph3P=CH−CH2−R。
穩定的威悌試劑
[編輯]比較穩定的威悌試劑通常含有能夠穩定類似碳負離子的碳上的負電荷的基團,例如在α碳上含有羰基的Ph3P=CH−COOR、Ph3P=CH−Ph。它們比簡單的葉立德要穩定,且一般不與酮反應。對於不活潑葉立德和酮的反應可以參見Horner-Wadsworth-Emmons反應。
穩定的葉立德可通過用較弱的鹼來處理鏻鹽製備,比如醇鹽,有時也可用氫氧化鈉和碳酸鈉。它們在威悌反應中通常生成E型為主的產物,即含羰基基團與β碳原子上較大的基團處於異側。
結構
[編輯]威悌試劑的結構可通過葉立德式,或更常見的含P=C雙鍵的Phosphorane式來描述:
但是該共振式中磷超過了八隅律的要求。這個超價性質尚不能用經典理論解釋。此外其共振傾向也不如烯烴和亞胺中p-p軌域交蓋的π鍵強烈,意味著葉立德式對混成體的貢獻較大,碳原子具有親核性。
應用和限制
[編輯]由於應用性廣泛,威悌反應已經成為烯烴合成的重要方法。它與脫去反應(例如鹵代烴的脫鹵化氫反應)不同的是,脫去反應得到由柴瑟夫規則決定的結構異構物的混合物,而威悌反應得到雙鍵固定的烯烴。
很多醛和酮都可發生該反應,但羧酸衍生物(如酯)反應性不強。因此大多數情況下,單、二和三取代的烯烴都可以較高產率通過該反應製得。羰基化合物可以帶著-OH、-OR、芳香-NO2甚至酯基官能基進行反應。
有位阻的酮類反應效果不理想,反應較慢且產率不高,尤其是在與穩定的葉立德反應時。可以用Horner-Wadsworth-Emmons反應來彌補這個不足。而且該反應對不穩定的醛類也不是很適合,包括易氧化、聚合或分解的醛。在「Tandem氧化威悌反應」中,威悌反應中的醛是由相應的醇在原地氧化獲得的。[15]
由於以二級鹵烷作原料生成鏻鹽的產率很低,因此威悌試劑一般由一級鹵烷反應得到。這意味著四取代的烯烴最好通過其它方法來製取。但威悌試劑對很多基團都有很好的耐受性,包括烯烴、芳香環、醚類甚至酯基和與葉立德共軛的C=O和氰基。含兩個P=C鍵的雙葉立德也已成功製得並應用於反應中。
此外還有一個與產物立體化學相關的限制。對於簡單的葉立德,產物主要是Z型,用酮反應時E型比例高些。而當反應在DMF中和LiI或NaI存在下反應時,產物卻幾乎全都是Z型的。[16] 這種情況下可以通過Schlosser改進來獲得E型產物。對於穩定的葉立德和Horner-Wadsworth-Emmons反應,產物主要為E型。
Schlosser改進
[編輯]
傳統威悌反應的主要限制在於,反應主要經由赤型的偶極中間體,從而導致Z型烯烴的生成。但Schlosser和Christmann[17] 發現,在低溫及苯基鋰和HCl的存在下,蘇型的中間體占主要地位,因此主要產物為E型烯烴。
科里和山本進一步發現,通過用偶極中間體葉立德與一個二級醛反應,該改進可以被用於烯丙醇的立體選擇性合成。[18] 例如:

應用舉例
[編輯]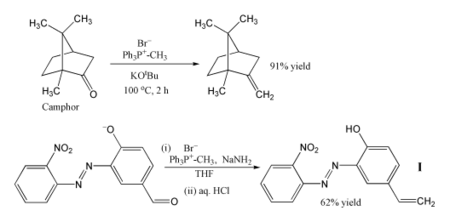
由於該反應具有很強的應用性,因此它已經成為有機合成化學家十分重要的工具。[19]
最常見的應用,即是用亞甲基三苯基膦(Ph3P=CH2)向分子中引入亞甲基。在上面的例子中,即便是樟腦這種有位阻的酮,都可通過與甲基三苯基溴化鏻和叔丁醇鉀共熱(產生威悌試劑)而被轉化為其亞甲基衍生物。[20] 在另外一個例子中,以胺基鈉作為鹼產生葉立德,成功以62%的產率將反應物醛轉化為烯烴I。[21] 這個反應是低溫在THF中進行的,比較敏感的硝基、偶氮基和酚鹽負離子都沒有干擾反應。產物可用作聚合物的光穩定劑,防止聚合物被紫外線破壞。
白三烯A甲酸酯的合成中也涉及到了威悌反應。[22][23] 第一步使用了一個穩定的葉立德,其中羰基與葉立德共軛以防止自身縮合,但還是意外地得到了順式為主的產物。第二個威悌反應則使用的是一個活潑的威悌試劑,產物也主要是順式。需要注意的是環氧化合物和酯都沒有對反應造成干擾。

甲氧基亞甲基三苯基膦是一個威悌試劑,可用於醛的同系化反應。
參見
[編輯]參考資料
[編輯]- ^ Georg Wittig, Ulrich Schöllkopf. Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien I. Chemische Berichte. 1954, 87: 1318. doi:10.1002/cber.19540870919.
- ^ Georg Wittig, Werner Haag. Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien II. Chemische Berichte. 1955, 88: 1654–1666. doi:10.1002/cber.19550881110.
- ^ Maercker, A. Org. React. 1965, 14, 270-490. (Review)
- ^ W. Carruthers, Some Modern Methods of Organic Synthesis, Cambridge University Press, Cambridge, UK, 1971, pp81-90. (ISBN 0-521-31117-9)
- ^ R. W. Hoffmann. Wittig and His Accomplishments: Still Relevant Beyond His 100th Birthday. Angewandte Chemie International Edition. 2001, 40 (8): 1411–1416. doi:10.1002/1521-3773(20010417)40:8%3C1411::AID-ANIE1411%3E3.0.CO;2-U.
- ^ E. Vedejs and C. F. Marth. Mechanism of Wittig reaction: evidence against betaine intermediates. J. Am. Chem. Soc. 1990, 112 (10): 3905–3909. doi:10.1021/ja00166a026.
- ^ B. E. Maryanoff, A. B. Reitz, M. S. Mutter, R. R. Inners, and H. R. Almond, Jr., "Detailed Rate Studies on the Wittig Reaction of Non-Stabilized Phosphorus Ylides via 31P, 1H, and 13C NMR Spectroscopy. Insight into Kinetic vs. Thermodynamic Control of Stereochemistry", J. Am. Chem. Soc., 107, 1068-1070 (1985)
- ^ B. E. Maryanoff, A. B. Reitz, D. W. Graden, and H. R. Almond, Jr., "NMR Rate Study on the Wittig Reaction of 2,2-Dimethylpropanal and Tributylbutylidene-phosphorane", Tetrahedron Lett., 30, 1361-1364 (1989)
- ^ B. E. Maryanoff, A. B. Reitz, M. S. Mutter, R. R. Inners, H. R. Almond, Jr., R. R. Whittle, and R. A. Olofson, "Stereochemistry and Mechanism of the Wittig Reaction. Diastereomeric Reaction Intermediates and Analysis of the Reaction Course", J. Am. Chem. Soc., 108, 7664-7678 (1986)
- ^ A. B. Reitz, S. O. Nortey, A. D. Jordan, Jr., M. S. Mutter, and B. E. Maryanoff, "Dramatic Concentration Dependence of Stereochemistry in the Wittig Reaction. Examination of the Lithium-Salt Effect", J. Org. Chem., 51, 3302-3308 (1986)
- ^ E. Vedejs, C. F. Marth and R. Ruggeri. Substituent effects and the Wittig mechanism: the case of stereospecific oxaphosphetane decomposition. J. Am. Chem. Soc. 1988, 110 (12): 3940–3948. doi:10.1021/ja00220a036.
- ^ E. Vedejs and C. F. Marth. Mechanism of the Wittig reaction: the role of substituents at phosphorus. J. Am. Chem. Soc. 1988, 110 (12): 3948–3958. doi:10.1021/ja00220a037.
- ^ Vedejs, E.; Peterson, M. J. Top. Stereochem. 1994, 21, 1.
- ^ 邢其毅等。《基礎有機化學》第三版上冊。北京:高等教育出版社,2005年。ISBN 7-04-016637-2
- ^ Richard J. K. Taylor, Leonie Campbell, and Graeme D. McAllister (2008). "(±) trans-3,3'-(1,2-Cyclopropanediyl)bis-2-(E)-propenoic Acid, Diethyl Ester: Tandem Oxidation Procedure (TOP) using MnO2 Oxidation-Stabilized Phosphorane Trapping 網際網路檔案館的存檔,存檔日期2011-06-05.". Org. Synth. 85: 15-26.
- ^ L. D. Bergelson and M. M. Shemyakin. Synthesis of Naturally Occurring Unsaturated Fatty Acids by Sterically Controlled Carbonyl Olefination. Angew. Chem. 1964, 3 (4): 250–260. doi:10.1002/anie.196402501.
- ^ M. Schlosser and K. F. Christmann. Trans-Selective Olefin Syntheses. Angewandte Chemie International Edition in English. 1966, 5 (1): 126. doi:10.1002/anie.196601261.
- ^ E. J. Corey and H. Yamamoto. Modification of the Wittig reaction to permit the stereospecific synthesis of certain trisubstituted olefins. Stereospecific synthesis of α-santalol. J. Am. Chem. Soc. 1970, 92 (1): 226–228. doi:10.1021/ja00704a052.
- ^ B. E. Maryanoff and A. B. Reitz. The Wittig olefination reaction and modifications involving phosphoryl-stabilized carbanions. Stereochemistry, mechanism, and selected synthetic aspects. Chem. Rev. 1989, 89 (4): 863–927. doi:10.1021/cr00094a007.
- ^ Fitjer, L.; Quabeck, U. Synthetic Communications 1985, 15(10), 855-864.
- ^ F. A. Bottino, G. Di Pasquale, A. Pollicino, A. Recca and D. T. Clark. Synthesis of 2-(2-hydroxyphenyl)-2H-benzotriazole monomers and studies of the surface photostabilization of the related copolymers. Macromolecules. 1990, 23 (10): 2662–2666. doi:10.1021/ma00212a011.
- ^ I. Ernest, A. J. Main and R. Menasse. Synthesis of the 7-cis isomer of the natural leukotriene d4. Tetrahedron Letters. 1982, 23 (2): 167–170. doi:10.1016/S0040-4039(00)86776-3.
- ^ E. J. Corey, D. A. Clark, G. Goto, A. Marfat, C. Mioskowski, B. Samuelsson and S. Hammarstroem. Stereospecific total synthesis of a "slow reacting substance" of anaphylaxis, leukotriene C-1. J. Am. Chem. Soc. 1980, 102 (4): 1436–1439. doi:10.1021/ja00524a045.
外部連結
[編輯]- 威悌反應—Organic Syntheses, Coll. Vol. 10, p. 703 (2004); Vol. 75, p. 153 (1998). (文章 (頁面存檔備份,存於網際網路檔案館))
- 威悌反應—Organic Syntheses, Coll. Vol. 5, p. 361 (1973); Vol. 45, p. 33 (1965). (文章 (頁面存檔備份,存於網際網路檔案館))


