過氧磷酸
| 過氧磷酸 | |
|---|---|

| |
| IUPAC名 peroxyphosphoric acid | |
| 系統名 (dioxidanido)dihydroxidooxidophosphorus | |
| 英文名 | Peroxymonophosphoric acid |
| 別名 |
|
| 識別 | |
| CAS號 | 13598-52-2 |
| PubChem | 6326786 |
| ChemSpider | 4885506 |
| SMILES |
|
| InChI |
|
| ChEBI | 29282 |
| 性質 | |
| 化學式 | H3PO5 |
| 莫耳質量 | 114.00 g·mol⁻¹ |
| 外觀 | 無色液體 |
| 溶解性 | 可溶於乙腈和1,4-二氧六環 |
| pKa | 0.92±0.10(25 °C)[1] |
| 相關物質 | |
| 相關化學品 | 過氧焦磷酸 磷酸 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
過氧磷酸,化學式 H
3PO
5,是一種磷的含氧酸,易溶於水。它是兩種磷的過氧酸之一,另一種是過氧焦磷酸。
歷史
[編輯]兩種磷的過氧酸都是在1910年由Julius Schmidlin和Paul Massini通過五氧化二磷與高濃度過氧化氫之間的反應首次合成並表徵的。[2]不過,這個反應非常劇烈,很難控制。除了五氧化二磷之外,還報道了從偏磷酸和焦磷酸開始合成的方法。
Gerrit Toennies 在1937年描述了一種通過引入惰性溶劑乙腈來製備過氧磷酸的不太劇烈的方法。該方法被證明不適用於乙醚或異戊醇溶劑。[3]
製備
[編輯]過氧磷酸最廣泛使用的製備方法是將過氧焦磷酸鹽在強酸如高氯酸中水解。[4]它的前體過氧焦磷酸鹽則可以通過電解磷酸鹽而成。[5]
它也可以由五氧化二磷與高濃度過氧化氫在乙腈或四氯化碳等惰性溶劑中反應而成。[4]
性質
[編輯]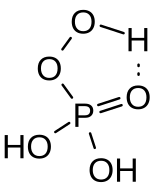
過氧磷酸是一種無色的黏液體。它被分子內氫鍵穩定化。[6]過氧磷酸是三元酸,酸度係數 pKa1 = 1.1、pKa2 = 5.5 和pKa3 = 12.8。在水溶液中,它會緩慢水解成過氧化氫和磷酸。[7]
過氧磷酸水解的半衰期取決於 pH 值和溫度,在 35 °C 下約為 31 小時,在 61 °C 下約為 2.5 小時。[7]它的乙腈溶液也會緩慢降解,在 5°C 下儲存 26 天后會損失 30% 的活性氧。[6]相對穩定的過氧磷酸鹽可以由中和反應產生,例如和氫氧化鉀反應產生吸濕性的過氧磷酸二氫鉀 KH2PO5。[5]
用途和反應
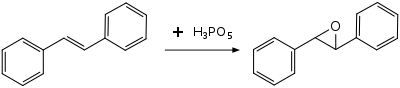
[編輯]過氧磷酸在有機合成中用作親電試劑,用於氧化烯烴、炔烴、芳香族化合物和胺。由於它的強酸性,它只能製備相對對酸穩定的環氧化物,例如從(E)-二苯基乙烯製備(E)-二苯基環氧乙烷。不太穩定的環氧化物被裂解或進一步反應,它和環己烯、苯乙烯和α-甲基苯乙烯的反應不會形成可分離的環氧化物。在苯乙烯和α-甲基苯乙烯的情況下,酸催化的烷基遷移導致主要產物分別為苯乙酸和2-苯基丙酸。[8]
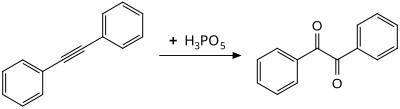
過氧磷酸在室溫下氧化二苯基乙炔會產生二苯基乙二酮,可能通過了一個環氧乙烯衍生物中間體。[9]
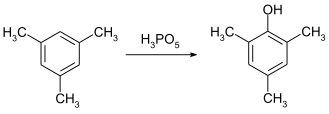
過氧磷酸是芳香環羥基化的有效試劑。在室溫下,它可以在四小時內把均三甲苯羥基化成2,4,6-三甲基苯酚。[10]
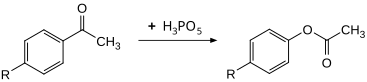
在拜耳-維立格氧化反應中,過氧磷酸是一種有效的氧化劑。苯乙酮衍生物可以在 30 °C 下以高產率轉化為相應的苯乙酸酯。與使用過氧苯甲酸來氧化相比,反應速率大約高出100倍。[11]

參考資料
[編輯]- ^ Calculated using Advanced Chemistry Development (ACD/Labs) Software V11.02 (© 1994-2021 ACD/Labs). Retrieved from SciFinder. [2021-09-07].
- ^ Schmidlin, Julius; Massini, Paul. Phosphormonopersäure und Überphosphorsäure. Ber. Dtsch. Chem. Ges. 1910, 43 (1): 1162–1171. doi:10.1002/cber.191004301195.
- ^ Toennies, Gerrit. A New Method for the Preparation of Permonophosphoric Acid. J. Am. Chem. Soc. 1937, 59 (3): 555–557. doi:10.1021/ja01282a037.
- ^ 4.0 4.1 Zhu, Tian; Chang, Hou-Min; Kadia, John F. A New Method for the Preparation of Peroxymonophosphoric Acid. Can. J. Chem. 2003, 81 (2): 156–160. doi:10.1139/v03-010.
- ^ 5.0 5.1 Harald, Jakob; Leininger, Stefan; Lehmann, Thomas; Jacobi, Sylvia; Gutewort, Sven. Peroxo Compounds, Inorganic. Ullmann's Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag. 2007: 310–311. ISBN 9783527306732. doi:10.1002/14356007.a19_177.pub2.
- ^ 6.0 6.1 6.2 Rao, A. Somasekar; Mohan, H. Rama. Monoperoxyphosphoric Acid. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. 2001. ISBN 9780470842898. doi:10.1002/047084289X.rm287m.
- ^ 7.0 7.1 Battaglia, Charles J.; Edwards, John O. The Dissociation Constants and the Kinetics of Hydrolysis of Peroxymonophosphoric Acid. Inorg. Chem. 1965, 4 (4): 552–558. doi:10.1021/ic50026a024.
- ^ Ogata, Yoshiro; Tomizawa, Kohtaro; Ikeda, Toshiyuki. Oxidation of trans-Stilbene with Peroxymonophosphoric Acid. J. Org. Chem. 1979, 44 (14): 2362–2364. doi:10.1021/jo01328a006.
- ^ Ogata, Yoshiro; Sawaki, Yasuhiko; Ohno, Takashi. Mechanism for Oxidation of Phenylacetylenes with Peroxymonophosphoric acid. Oxirene as an Intermediate Inconvertible to Ketocarbene. J. Am. Chem. Soc. 1982, 104 (1): 216–219. doi:10.1021/ja00365a039.
- ^ Ogata, Yoshiro; Sawaki, Yasuhiko; Tomizawa, Kohtaro; Ohno, Takashi. Aromatic Hydroxylation with Peroxymonophosphoric Acid. Tetrahedron. 1981, 37 (8): 1485–1486. doi:10.1016/S0040-4020(01)92087-3.
- ^ Ogata, Yoshiro; Tomizawa, Kohtaro; Ikeda, Toshiyuki. Kinetics of the Baeyer-Villiger Reaction of Acetophenones with Permonophosphoric Acid. J. Org. Chem. 1978, 43 (12): 2417–2419. doi:10.1021/jo00406a025.
- ^ Ogata, Yoshiro; Tomizawa, Kohtaro; Morikawa, Takashi. Kinetics of the Peroxymonophosphoric Acid Oxidation of Aromatic Amines. J. Org. Chem. 1979, 44 (3): 352–355. doi:10.1021/jo01317a009.




![{\displaystyle {\ce {P2O8^{4}-+H2O->[ \atop {\ce {HClO_{4}}}]{H3PO5}+H3PO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe1c24231286229cb984cf20478d4a27ace42b03)

