魯米諾
外觀
| 魯米諾[1] | |
|---|---|
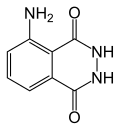
| |

| |
| IUPAC名 5-Amino-2,3-dihydro- 1,4-phthalazinedione | |
| 別名 | 發光胺,3-胺基鄰苯二甲醯肼 |
| 識別 | |
| CAS編號 | 521-31-3 |
| PubChem | 10638 |
| ChemSpider | 10192 |
| SMILES |
|
| InChI |
|
| InChIKey | HWYHZTIRURJOHG-UHFFFAOYAB |
| EINECS | 208-309-4 |
| 性質 | |
| 化學式 | C8H7N3O2 |
| 莫耳質量 | 177.16 g·mol⁻¹ |
| 熔點 | 319-320 ℃ |
| 危險性 | |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
魯米諾(英文:Luminol),或稱發光胺、光敏靈、流明諾,是通用的發光化學試劑,與適當的氧化劑混合時會發出引人注目的藍色光。它是白色至淡黃色的晶體,可溶於大多數有機極性溶劑,但不溶於水。
法醫學上使用魯米諾來檢驗犯罪現場含有的痕量血跡,生物學上則使用魯米諾來檢測細胞中的銅、鐵及氰化物的存在。
化學
[編輯]合成
[編輯]3-硝基鄰苯二甲酸可作為魯米諾的合成原料。[2][3] 3-硝基鄰苯二甲酸與肼在高沸點溶劑(如二甘醇)中發生縮合反應,失去一分子水,生成3-硝基鄰苯二甲醯肼。然後以保險粉還原3-硝基鄰苯二甲醯肼中的硝基,得到3-胺基鄰苯二甲醯肼,即是魯米諾。
化學發光
[編輯]魯米諾只有用氧化劑處理過才會發光。通常使用雙氧水和一種氫氧化物鹼的混合水溶液作為激發劑。在鐵化合物催化下,雙氧水分解為氧氣和水:
- 2 H2O2 → O2 + 2 H2O
實驗室中常以鐵氰化鉀作為催化劑鐵的來源,而法醫學上的催化劑則恰好是血紅蛋白中的鐵。很多生物系統中的酶也可催化過氧化氫的分解反應。
魯米諾與氫氧化物反應時生成了一個雙負離子(Dianion,見圖),它可被過氧化氫分解出的氧氣氧化,產物為一個有機過氧化物。該過氧化物很不穩定,立即分解出氮氣,生成激發態的3-胺基鄰苯二甲酸。激發態至基態轉化中,釋放的能量以光子的形式存在,波長位於可見光的藍光部分。

犯罪現場調查中的應用
[編輯]理論
[編輯]即使犯罪現場的血跡已經被擦過或清除過,法醫依舊可以使用魯米諾找到它們的位置。實際上,調查者在要調查的區域內噴灑魯米諾和激發劑溶液, 再使用紫外光燈,血中的鐵立即催化魯米諾的發光反應,使其產生藍色光芒。該反應需用的催化劑量非常少,因此魯米諾可以檢測痕量的血跡。發光大約持續30秒鐘,可通過長曝光的照片觀察出,其周圍環境不可以太亮。
缺點
[編輯]魯米諾有一些缺點限制了它的應用:
- 魯米諾在銅、含銅合金、辣根或某些漂白劑的存在下發出螢光。因此如果犯罪現場被漂白劑徹底處理過,則魯米諾發出的螢光會強烈掩蓋任何血跡的存在。
- 魯米諾可以檢測出動物血及尿中的少量血,因此如果待測房間中含有尿或動物血,檢測結果會有偏差。
- 魯米諾與排泄物反應,發出的光與和血反應發出的是相同的。
- 魯米諾可能干擾其他檢測,然而魯米諾並不干擾DNA的提取。[4]
- 只適用於面積較大以及血漬分散的犯案現場。
參考資料
[編輯]- ^ Merck Index, 11th Edition, 5470.
- ^ Huntress et al., J. Am. Chem. Soc., 1934, 241.
- ^ Synthesis of luminol 網際網路檔案館的存檔,存檔日期2009-04-25.
- ^ Technical note about Hemaglow 網際網路檔案館的存檔,存檔日期2008-10-26.



