討論:N-溴代丁二醯亞胺
|
本條目頁依照頁面評級標準評為乙級。 本條目頁屬於下列維基專題範疇: |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||
| N-溴代丁二醯亞胺曾於2015年7月9日通過新條目推薦投票,登上維基百科首頁的「你知道嗎?」欄位。 |
 | 此條目為第十三次動員令多於15種外語版本的條目類的作品之一,是一篇達標條目。 |
從英文版翻譯
[編輯]| N-溴代丁二醯亞胺 | |
|---|---|

| |

| |
| IUPAC名 1-Bromo-2,5-pyrolidinedione | |
| 別名 | N-bromosuccinimide; NBS |
| 識別 | |
| CAS號 | 128-08-5 |
| SMILES |
|
| 性質 | |
| 化學式 | C4H4BrNO2 |
| 莫耳質量 | 177.98 g·mol⁻¹ |
| 外觀 | White solid |
| 密度 | 2.098 g/cm3 (solid) |
| 熔點 | 175 - 178 °C |
| 溶解性(水) | 1.47 g / 100 mL (25 °C) |
| 危險性 | |
| 主要危害 | Irritant |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
N-Bromosuccinimide or NBS is a chemical reagent which is used in radical substitution and electrophilic addition reactions in organic chemistry. NBS can be considered a convenient source of bromine.
Chemistry
[編輯]Addition to alkenes
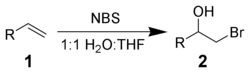
[編輯]NBS will react with alkenes 1 in aqueous solvents to give bromohydrins 2. The preferred conditions are the portionwise addition of NBS to a solution of the alkene in 50% aqueous DMSO, DME, THF, or tert-butanol at 0°C.[1] Formation of a bromonium ion and immediate attack by water gives strong Markovnikov addition and anti stereochemical selectivities.[2]
Side reactions include the formation of α-bromo-ketones and dibromo compounds. These can be minimized by the use of freshly recrystallized NBS.
With the addition of nucleophiles, instead of water, various bifunctional alkanes can be synthesized.[3]
Allylic and benzylic bromination
[編輯]Standard conditions for using NBS in allylic and/or benzylic bromination involves refluxing a solution of NBS in anhydrous CCl4 with a radical initiator, usually azo-bis-isobutyronitrile (AIBN), benzoyl peroxide, irradiation, or both to effect radical initiation.[4][5] This is also called the Wohl-Ziegler reaction.[6][7]
The carbon tetrachloride must be maintained anhydrous throughout the reaction, as the presence of water may likely hydrolyze the desired product.[8] Barium carbonate is often added to maintain anhydrous and acid-free conditions.
Bromination of carbonyl derivatives
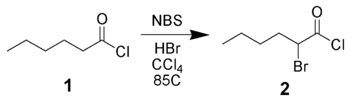
[編輯]NBS can α-brominate carbonyl derivatives via either a radical pathway (as above) or via acid-catalysis. For example, hexanoyl chloride 1 can be brominated in the alpha-position by NBS using acid catalysis.[9]
The reaction of enolates, enol ethers, or enol acetates with NBS is the preferred method of α-bromination as it is high-yielding with few side-products.[10][11]
Bromination of aromatic derivatives
[編輯]Electron-rich aromatic compounds, such as phenols, anilines, and various aromatic heterocycles[12], can be brominated using NBS.[13][14] Using DMF as the solvent gives high levels of para-selectivity.[15]
Hofmann rearrangement
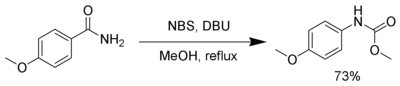
[編輯]NBS, in the presence of a strong base, such as DBU, reacts with primary amides to produce a carbamate via the Hofmann rearrangement.[16]
Selective oxidation of alcohols
[編輯]It is uncommon, but possible for NBS to oxidize alcohols. E. J. Corey et al. found that one can selectively oxidize secondary alcohols in the presence of primary alcohols using NBS in aqueous DME.[17]
Preparation
[編輯]NBS is commercially available. It can also be synthesized in the laboratory. To do so, sodium hydroxide and bromine are added to an ice-water solution of succinimide. The NBS product precipitates out and can be collected by filtration.
Crude NBS gives better yield in the Wohl-Ziegler reaction. In other cases, impure NBS (slightly yellow-colored) may give unreliable results. It can be purified by recrystallization from 90-95 °C water.
Precautions
[編輯]Although NBS is easier and safer to handle than bromine, precautions should be taken to avoid inhalation. NBS should be stored in a refrigerator. NBS will decompose over time giving off bromine. Pure NBS is white, but it is often found to be off-white or brown colored by bromine.
In general, reactions involving NBS are exothermic. Therefore, extra precautions should be taken when used on a large scale.
See also
[編輯]References
[編輯]- ^ Hanzlik, R. P. Organic Syntheses, Coll. Vol. 6, p.560 (1988); Vol. 56, p.112 (1977). (Article)
- ^ Beger, J. J. Prakt. Chem. 1991, 333(5), 677-698.
- ^ Haufe, G.; Alvernhe, G.; Laurent, A.; Ernet, T.; Goj, O.; Kröger, S.; Sattler, A. Organic Syntheses, Coll. Vol. 10, p.128 (2004); Vol. 76, p.159 (1999). (Article)
- ^ Djerassi, C.; Chem. Rev. 1948, 43, 271.
- ^ Greenwood, F. L.; Kellert, M. D.; Sedlak, J. Organic Syntheses, Coll. Vol. 4, p.108 (1963); Vol. 38, p.8 (1958). (Article)
- ^ Wohl, A. Ber. 1919, 52, 51.
- ^ Ziegler, K.; et al. Ann. 1942, 551, 30.
- ^ Binkley, R. W.; Goewey, G. S.; Johnston, J; J. Org. Chem. 1984, 49, 992.
- ^ Harpp, D. N.; Bao, L. Q.; Coyle, C.; Gleason, J. G.; Horovitch, S. Organic Syntheses, Coll. Vol. 6, p.190 (1988); Vol. 55, p.27 (1976). (Article)
- ^ Stotter, P. L.; Hill, K. A.; J. Org. Chem. 1973, 38, 2576.
- ^ Lichtenthaler, F. W.; et al. Synthesis 1992, 179.
- ^ Amat, M.; Hadida, S.; Sathyanarayana, S.; Bosch, J. Organic Syntheses, Coll. Vol. 9, p.417 (1998); Vol. 74, p.248 (1997). (Article)
- ^ Gilow, H. W.; Burton, D. E.; J. Org. Chem. 1981, 46, 2221.
- ^ Brown. W. D.; Gouliaev, A. H. Organic Syntheses, Vol. 81, p.98 (2005). (Article)
- ^ Mitchell, R. H.; Lai, Y.-H.; Williams, R. V.; J. Org. Chem. 1979, 44, 4733.
- ^ Keillor, J. W.; Huang, X. Organic Syntheses, Coll. Vol. 10, p.549 (2004); Vol. 78, p.234 (2002). (Article)
- ^ Corey, E. J.; Ishiguro, M. Tetrahedron Lett. 1979, 20, 2745-2748.
External links
[編輯]{{DEFAULTSORT:Bromosuccinimide, N-}} [[:Category:Organobromides]] [[:Category:Reagents for organic chemistry]] [[:de:N-Bromsuccinimid]] [[:ja:N-ブロモスクシンイミド]] [[:pl:NBS]]
-Zhuhui 2007年8月1日 (三) 19:43 (UTC)
掛disputed維護模板
[編輯]各位可參考WP:DYKC候選區的意見進行改善。--食人魔國王Talk 2015年7月9日 (四) 02:39 (UTC)
- 第一點所述內容已刪除,第三點及之後各點已經改善。第二點留待原作者處理。--William915(與我討論) 2015年7月9日 (四) 13:27 (UTC)
- @William915:不好意思這麼晚才回覆您,感謝您再次為我的不專業翻譯抓出錯誤
- 1.這部分我太粗心了,寫的時候竟然把整段文字給遺漏了,已補上。
- 2.的確文獻上沒有註明溫度,經過搜尋之後也沒有找到相關資料,所以刪除。
- 3.我來試試看能不能直接改圖
- 謝謝您幫我改正第4條之後的問題。原來在有文獻支持的狀況下還有這麼多不準確!之後做翻譯的時候我會多多注意的,還請多多指教了。
- (PS. 根據使用者:和平奮鬥救地球/自然科學條目提升計劃的統計,雖然化學類的條目在維基的自然科條目中相對算是不缺乏的,但許多最基本的條目內容還是相當不足,還請您有空的話多多關注他們,最近發現我這種非化學本科專業的學生寫起條目來還是有極限的,許多條目好像看得懂卻都不敢碰><″)--Yrr933!(留言) 2015年7月10日 (五) 07:42 (UTC)
- @William915:不好意思這麼晚才回覆您,感謝您再次為我的不專業翻譯抓出錯誤
新條目推薦討論

- 在有機合成上,哪種試劑被廣泛應用於自由基取代反應和親電加成反應中,並可當作溴的替代物?。
 說明:條目翻譯自英文維基,擴充約8400位元組--Yrr933!(留言) 2015年7月5日 (日) 08:33 (UTC)
說明:條目翻譯自英文維基,擴充約8400位元組--Yrr933!(留言) 2015年7月5日 (日) 08:33 (UTC)- (+)支持:符合標準,部分錯字與N的斜體顯示問題已作修改。--William915(與我討論) 2015年7月5日 (日) 08:56 (UTC)
- (+)支持:符合標準。--V (1984) 2015年7月5日 (日) 08:48 (UTC)
- (+)支持:符合標準。--Walter Grassroot (♬) 2015年7月6日 (一) 13:01 (UTC)
- (+)支持:符合標準。4Li 2015年7月7日 (二) 01:42 (UTC)
- (+)支持,符合標準。--Iflwlou [ M { 2015年7月7日 (二) 07:14 (UTC)
- @Yrr933!:
- 你告訴我,「將0.16莫耳(約16 g)的丁二醯亞胺溶於至於冰浴中的氫氧化鈉溶液中(6.4 g溶入40 mL水中並加入30 g碎冰),持續攪拌約5分鐘後,過濾並以清水清洗產物」的過程中有沒有發生核反應?溴從哪裡來?--Antigng(留言) 2015年7月7日 (二) 08:05 (UTC)
- 來源4中何處提到「進行此反應的最佳條件是在0 °C下,將NBS分批加入烯烴的DMSO或DME或THF或叔丁醇其中之一的50 %水溶液中。」--Antigng(留言) 2015年7月7日 (二) 08:17 (UTC)
- 右圖有錯,反應產物應當是消旋的。

- 「進行烯丙基類與苯甲基類化合物的溴化反應的基本條件是在迴流裝置中將NBS溶入無水四氯化碳。」溶嗎?9號、10號注釋失效,無法查證。--Antigng(留言) 2015年7月7日 (二) 08:22 (UTC)
- 「然而為了使此反應有較高的產率和較少其他副產物產生,通常會使用NBS加上烯醇或烯醇醚,這樣也能產生α-溴化反應。」腳註13明明是烯醇鋰鹽的溴化反應,怎麼在條目里寫成了烯醇與NBS德反應?有多少烯醇可以穩定存在?--Antigng(留言) 2015年7月7日 (二) 08:30 (UTC)
- 「擁有高電子密度的芳香類化合物像是酚、苯胺或雜環化合物……」雜環化合物都具有高電子密度?你可以試試用NBS給吡啶溴化。--Antigng(留言) 2015年7月7日 (二) 08:33 (UTC)
- 「霍夫曼重排反應則是以一級醯胺和NBS與強鹼(如DBU)反應產生胺基甲酸酯。」哪個來源這麼說的?原文標題"METHYL CARBAMATE FORMATION VIA MODIFIED HOFMANN REARRANGEMENT REACTIONS",英文MODIFIED是什麼意思?--Antigng(留言) 2015年7月7日 (二) 08:35 (UTC)
- (-)反對:內容欠準確,請主編回應並改善上述問題。--食人魔國王Talk 2015年7月9日 (四) 02:35 (UTC)