霍亂毒素

霍亂毒素(英語:Cholera toxin,又稱為英語:choleragen,有時簡稱為CTX、Ctx 或 CT)是霍亂弧菌分泌的AB5多聚體蛋白質複合體。[1][2]霍亂毒素是造成霍亂感染特有的大量水瀉的原因。[3]它是耐熱腸毒素家族的成員。
歷史
[編輯]羅伯特·科赫是一位德國醫生和微生物學家,他是第一個提出霍亂毒素存在的人。1886年,科赫提出霍亂弧菌會分泌一種導致霍亂症狀的物質。[4]科赫的推測被印度微生物學家 Sambhu Nath De 證實是正確的,他在1951年研究並記錄了用熱殺霍亂弧菌注射兔子的效果。[5]他從這個實驗中得出結論:細菌分解時釋放出來的內毒素是導致霍亂症狀的原因。[5]1959年,De 進行了另一項實驗,這次他使用無菌的霍亂弧菌培養濾液注入兔子的小腸。[6]結果腸內積液確實證明了毒素的存在。[7]
結構
[編輯]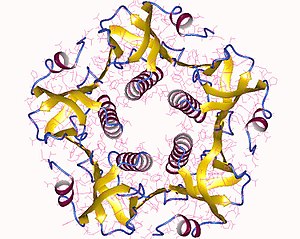
完整的毒素是由一份A亞基(A部分,酶,UniProt P01555)和五份B亞基(B部分,受體結合,UniProt P01556)組成的六聚體,表示為AB5。B亞基結合,而A亞基則活化 G蛋白,進而活化腺苷酸環化酶。該毒素的三維結構是由 Zhang 等人在1995年使用X射線晶體學測定的。[8]
五個各重11 kDa的B亞基構成一個五元環。28 kDa的A亞基有兩個重要的區段。A1部分的鏈 (CTA1) 是球狀的酶載荷,可二磷酸腺苷核糖基化化G蛋白,而A2鏈 (CTA2) 則形成延伸的α螺旋,緊貼在B亞基環的中央孔隙中。[9]
這種結構在形狀、機制和序列上與大腸桿菌某些菌株所分泌的耐熱腸毒素家族類似。
致病機制
[編輯]霍亂毒素的作用機制如下: 首先,霍亂毒素的B亞基環與目標細胞表面的GM1神經節苷脂結合。如果細胞缺乏GM1,毒素很可能會與其他類型的聚糖結合,例如附著在蛋白質上的Lewis Y和Lewis X,而不是脂質。[10][11][12] 一旦結合,整個毒素複合物會被細胞內吞,二硫橋的還原會釋放霍亂毒素A1 (CTA1) 鏈。胞內體被移動到高爾基體,在那裡A1蛋白被內質網 (ER) 分子伴侶蛋白二硫異構酶(protein disulfide-isomerase)識別。A1鏈隨後展開並被送到膜上,在膜上,Ero1觸發蛋白質二硫化異構酶複合物氧化,釋放A1蛋白。[13]當A1蛋白透過Sec61通道從內質網移動到細胞質時,它會重新折疊,避免因泛素化而失去活性。
參見
[編輯]參考資料
[編輯]- ^ Ryan KJ; Ray CG (編). Sherris Medical Microbiology 4th. McGraw Hill. 2004: 375. ISBN 978-0-8385-8529-0.
- ^ Faruque, Shah M; Nair, G. Balakrish (編). Vibrio cholerae: Genomics and Molecular Biology. Caister Academic Press. July 2008. ISBN 978-1-904455-33-2.
- ^ Aizpurua-Olaizola, Oier; Sastre Torano, Javier; Pukin, Aliaksei; Fu, Ou; Boons, Geert Jan; de Jong, Gerhardus J.; Pieters, Roland J. Affinity capillary electrophoresis for the assessment of binding affinity of carbohydrate-based cholera toxin inhibitors. Electrophoresis. 2018, 39 (2): 344–347. ISSN 1522-2683. PMID 28905402. S2CID 33657660. doi:10.1002/elps.201700207 (英語).
- ^ Bharati, Kaushik; Ganguly, Nirmal K. Cholera toxin: A paradigm of a multifunctional protein. The Indian Journal of Medical Research. February 2011, 133 (2): 179–187. ISSN 0971-5916. PMC 3089049
 . PMID 21415492.
. PMID 21415492.
- ^ 5.0 5.1 De, S. N.; Sarkar, J. K.; Tribedi, B. P. An experimental study of the action of cholera toxin. The Journal of Pathology and Bacteriology. 1951, 63 (4): 707–717. PMID 14898376. doi:10.1002/path.1700630417.
- ^ De, S. N. Enterotoxicity of bacteria-free culture-filtrate of Vibrio cholerae. Nature. 1959-05-30, 183 (4674): 1533–1534. ISSN 0028-0836. PMID 13666809. doi:10.1038/1831533a0.
- ^ Bharati, Kaushik; Ganguly, Nirmal K. Cholera toxin: A paradigm of a multifunctional protein. The Indian Journal of Medical Research. February 2011, 133 (2): 179–187. ISSN 0971-5916. PMC 3089049
 . PMID 21415492.
. PMID 21415492.
- ^ Zhang R, Scott D, Westbrook M, Nance S, Spangler B, Shipley G, Westbrook E. The three-dimensional crystal structure of cholera toxin. J Mol Biol. 1995, 251 (4): 563–73. PMID 7658473. doi:10.1006/jmbi.1995.0456
 .
.
- ^ De Haan L, Hirst TR. Cholera toxin: a paradigm for multi-functional engagement of cellular mechanisms (Review). Mol. Membr. Biol. 2004, 21 (2): 77–92. PMID 15204437. S2CID 22270979. doi:10.1080/09687680410001663267
 .
.
- ^ Amberlyn M Wands; Akiko Fujita. Fucosylation and protein glycosylation create functional receptors for Cholera toxin. eLife. October 2015, 4: e09545. PMC 4686427
 . PMID 26512888. doi:10.7554/eLife.09545
. PMID 26512888. doi:10.7554/eLife.09545  .
.
- ^ Cervin J, Wands AM, Casselbrant A, Wu H, Krishnamurthy S, Cvjetkovic A, et al. GM1 ganglioside-independent intoxication by Cholera toxin. PLOS Pathogens. 2018, 14 (2): e1006862. PMC 5825173
 . PMID 29432456. doi:10.1371/journal.ppat.1006862
. PMID 29432456. doi:10.1371/journal.ppat.1006862  .
.
- ^ Wands AM, Cervin J, Huang H, Zhang Y, Youn G, Brautigam CA, Matson Dzebo M, Björklund P, Wallenius V, Bright DK, Bennett CS, Wittung-Stafshede P, Sampson NS, Yrlid U, Kohler JJ. Fucosylated Molecules Competitively Interfere with Cholera Toxin Binding to Host Cells. ACS Infectious Diseases. February 7, 2018, 4 (5): 758–770. PMC 5948155
 . PMID 29411974. doi:10.1021/acsinfecdis.7b00085.
. PMID 29411974. doi:10.1021/acsinfecdis.7b00085.
- ^ Tsai, Billy; Rapoport, Tom A. Unfolded cholera toxin is transferred to the ER membrane and released from protein disulfide isomerase upon oxidation by Ero1. Journal of Cell Biology. 2002, 159 (2): 207–216. PMC 2173060
 . PMID 12403808. S2CID 3111310. doi:10.1083/jcb.200207120.
. PMID 12403808. S2CID 3111310. doi:10.1083/jcb.200207120.
外部鏈接
[編輯]- De, Sambhu Nath. Enterotoxicity of bacteria-free culture filtrate of Vibrio cholerae. Nature. 30 May 1959. 183:1533–4.
- McDowall, Jennifer. Cholera toxin. Protein of the Month (POTM). Protein Data Bank in Europe (PDBe). Sep 2005. (原始內容存檔於April 27, 2019).
- Goodsell, David. Cholera Toxin. RCSB Protein Data Bank. Molecule of the Month (MOTM) (Protein Data Bank (PDB)). Sep 2005. doi:10.2210/rcsb_pdb/mom_2005_9. (原始內容存檔於October 25, 2011).
- 醫學主題詞表(MeSH):Cholera+Toxin
- PDB中UniProt可用的所有結構信息之概述:P01555 (Cholera enterotoxin subunit A) 在PDBe-KB。
- PDB中UniProt可用的所有結構信息之概述:P01556 (Cholera enterotoxin subunit B) 在PDBe-KB。
